Der heutige Artikel widmet sich der Frage nach der Evidenz, nach der Wissenschaft hinter ketogenen Diäten, vor allem im Hinblick auf die Krebsbehandlung.
Was ist eine ketogene Diät?
Reduziert man den Kohlenhydrat- und Proteinanteil der Nahrung, so steht dem Körper eines seiner primären Substrate, Glukose (Traubenzucker), nicht mehr ausreichend zur Verfügung.
Auch der Proteinanteil spielt eine Rolle, denn aus diversen Aminosäuren kann der Körper bei Bedarf Glukose herstellen. Dieser Prozess findet in der Leber statt und nennt sich Gluconeogenese.
Häufig wird gesagt, dass ein niedriger Proteinanteil gegeben sein muss, um die Ketogenese (= Bildung von Ketonkörpern) zu garantieren. In der Tat bremst eine gesteigerten Proteinzufuhr die Ketogenese aufgrund von zwei wesentlichen Punkten: i) Damit die Leber Ketonkörper bilden kann, muss sich das sogenannten Acetyl-CoA (= Endstufe des Abbaus aller Substrate wie Glukose, Fettsäuren etc.) anreichern. Normalerweise gelangt dieses Acetyl-CoA in den Citrat-Zyklus und wird dort rasch verarbeitet, um daraus ATP (= Energie) zu synthetisieren. Diese Anreicherung von Acetyl-CoA wird dadurch begünstigt, dass ein eine Citrat-Zyklus-Komponente namens Oxaloacetat fehlt, weswegen der Citrat-Zyklus schlicht als Flaschenhals fungiert. Oxaloacetat kann aus Aminosäuren (also Protein) und aus Glukose (Traubenzucker) synthetisiert werden – heißt: Sowohl die Glukose-Verfügbarkeit, als auch die Aminosäure-Verfügbarkeit kann diesen Flaschenhals entweder verengen oder weiten. Damit Ketonkörper anfallen, muss sich Acetyl-CoA anreichern, weswegen eine niedrige Verfügbarkeit von Oxaloacetet (und somit Glukose bzw. Aminosäuren) essentiell ist. ii) Protein wirkt insulinogen (= sorgt für eine Insulinausschüttung), was zum einen die Fettverbrennung der Leber unterdrückt und zum anderen womöglich auch die Fettsäure-Freisetzung aus dem Fettgewebe unterdrückt.
Sinkt die Verfügbarkeit von Glukose stark, dann findet der Körper einen Ersatz namens Ketonkörper.
Beim Fettsäureabbau (ß-Oxidation) in der Leber entstehen als Abbauprodukt Acetyl-CoA-Moleküle, die sich anreichern und genutzt werden zur Synthese (= Bildung) von Ketonkörpern.
Jedes Gewebe ist in der Lage Fettsäuren und/oder entsprechend Ketonkörper zu verwenden, so dass der Energiebedarf gedeckt bleibt – auch völlig ohne die Zufuhr von Glukose.
Das zentrale Nervensystem, die Blutzellen und die Zellen des Nierenmarks können ausschließlich Glukose nutzen, weswegen der Körper konstant Glukose in Form von Blutzucker bereitstellt. Diese Glukose stammt aus der Leber.
Das Gehirn, das normalerweise Glukose und Laktat oxidiert, kann nach einigen Tagen der Umgewöhnung bis zu 75 % seines Energiebedarfs (Hall & Guyton, 2006) mit Hilfe von Ketonkörpern abdecken.
Geht man von 100 – 120 g Glukose aus, die das Gehirn täglich benötigt, so kann diese Zahl auf circa 30 g abgesenkt werden (Berg und Co-Autoren, 2002).
Im Zuge der Restriktion von Glukose und Aminosäuren sinkt entsprechend auch der Insulinspiegel, da Glukose und Aminosäure insulinogen wirken. Fällt diese insulinogene Wirkung weg, fällt auch der Insulinspiegel.
Insulin reguliert die Fettsäure-Freisetzung und biochemische Signalwege des Kohlenhydrat- bzw. Fettstoffwechsels. Genauer: Insulin kontrolliert die Expression von Enzymen, die den Fettstoffwechsel kontrollieren.
Es ist einleuchtend, dass ein niedriger Insulinspiegel zwangsläufig dazu führt, dass mehr freie Fettsäuren im Blut zirkulieren. Diese Fettsäure-Freisetzung aus dem Fettgewebe heißt Lipolyse. Wie du in meiner Artikelreihe zum Thema Fettsäuren gelernt hast, müssen auch die Nahrungsfette zunächst in das Fettgewebe wandern. Das bedeutet, dass Nahrungsfett immer den Umweg über das Fettgewebe nehmen muss, bevor Fettsäuren als Energiequelle von anderen Geweben genutzt werden können. Kleine Ausnahme: Kurz- und mittelkettige Fettsäuren stehen direkt als Energiequelle zur Verfügung.
Es ist also völlig unerheblich, ob man dem Körper Fettsäuren via Nahrung zuführt oder entsprechend die eigenen Fettreserven nutzt.
Physiologisch betrachtet sind das zwei sehr ähnliche Zustand, weswegen sehr häufig auch davon gesprochen wird, dass ketogene Diäten das Fasten mimen (= nachahmen).
Wir können also festhalten: Von ketogenen Diäten spricht man, wenn der Protein- und Kohlenhydratanteil der Nahrung deutlich gesenkt werden zugunsten von Fettsäuren, die entweder aus der Nahrung oder aus dem Fettgewebe stammen. In Folge der niedrigeren Glukose-Konzentration in der Leber, finden wir weniger Oxaloacetat, weswegen sich Acetyl-CoA-Molekül als Endprodukt des Fettstoffwechsels anreichern und zur Ketonkörper-Synthese genutzt werden. Diese Ketonkörper zirkulieren als Folge im Blut und können von Geweben genutzt werden.
Wieso möchte man ketogene Diäten in der Krebsbehandlung einsetzen?
Der Biochemiker Otto Warburg, Nobelpreisträger, erforschte Anfang/Mitte des letzten Jahrhunderts den Tumorstoffwechsel und stellte daraufhin seine Hypothese auf, die man heute als Warburg-Effekt oder Warburg-Hypothese kennt.
Er beobachtete, dass sich in der Umgebung von Krebs- bzw. Tumorzellen eine Laktatanreicherung findet. Laktat ist das Salz der Milchsäure, die bei der anaeroben (= ohne Beteiligung von Sauerstoff) Verstoffwechselung von Glukose entsteht. Dieses Phänomen kennen wir alle aus unserem Leben: Hohe muskuläre Belastung sorgt ebenfalls für eine Laktatanreicherung in den Muskelzellen, die sich aus der anaeroben Nutzung von Glukose als Energiequelle ergibt.
Normalerweise nutzen Körperzellen den aeroben Stoffwechsel. Das bedeutet, dass Glukose in den Mitochondrien vollständig abgebaut wird. Dazu bedarf es Sauerstoff.
Man kann einen anaeroben Stoffwechsel also generieren, indem man die Funktion der Mitochondrien einschränkt oder den Sauerstoffgehalt reduziert.
An dieser Stelle möchte ich nicht zu tief in die Thematik einsteigen, allerdings wird hier klar, warum eine mitochondriale Dysfunktion (wovon wir auf diesem Blog indirekt und häufig sprechen) im Zusammenhang mit der Krebsentwicklung steht.
Krebs- und Tumorzellen müssen rasch proliferieren (wachsen und vermehren) und benötigen daher eine effiziente Energiequelle. Warburg postulierte, dass die anfallende Milchsäure ein Zeichen dafür ist, dass Krebszellen Glukose als Energieträger nutzen.
Aus dieser Perspektive wird rasch klar, warum eine ketogene Diät helfen kann: Es reduziert die Glukoseverfügbarkeit und „entzieht“ der Tumorzelle somit die Energiegrundlage.
Ein weiterer positiver Effekt könnte außerdem sein, dass der für den Fastenstoffwechsel charakteristische zelluläre Schalter namens AMPK (= AMP-aktivierte-Proteinkinase) aktiv wird.
Dieses AMPK verlangsamt den Zellstoffwechsel, indem es die Zellteilung hemmt und Proteine anschaltet, die für das Zellüberleben essentiell sind. Die Idee dahinter ist, dass dieser Schalter einer Tumorentwicklung entgegen wirken kann.
Andere Effekte wie Ketonkörper als Deacetylase-Inhibitoren möchte ich an dieser Stelle nicht diskutieren.
Fast 100 Jahre später: Der „reverse Warburg effect„
Man muss wissen, dass Tumorzellen nicht einfache, primitive Zellen sind, so wie wir uns Neanderthaler im Vergleich zu uns häufig vorstellen, sondern zum Teil hoch spezifisch und metabolisch flexibel.
Es lag also eigentlich auf der Hand, dass es nicht die Tumorzelle gibt und dass es auch nicht das Substrat gibt, das Tumorzellen ausschließlich oxidieren.
Tatsächlich wurde schon zu Beginn der 90er-Jahre beobachtet, dass Tumorzellen auch Aminosäuren, Laktat und Ketonkörper oxidieren können. Mir ist aber lediglich ein Forscher bekannt, der dazu eine beeindruckende Experimentenreihe durchführte und dazu ausführlich berichtete. Darauf möchte ich im Verlauf eingehen.
2009 wurde von Dr. Michael Lisanti eine neue Hypothese ins Leben gerufen, basierend auf dem Stoffwechsel von Brustkrebszellen.
Die Umgebung der Zellen sind für das Zellwachstum verantwortlich
Der Großteil von Krebs- bzw. bösartigen Tumorzellen geht von Epithelzellen aus. (Woraus die Tumorzelle hervorgeht, ist häufig entscheidend. Wenn es also irgendwelche Studien gibt, die man da gerade liest, sollte man darauf achten, von welcher Tumorzelle wir überhaupt reden. Tumore, die aus Epithelzellen hervorgehen, nennen sich Carcinome und Tumore, die aus Bindegewebe hervorgehen, nennen sich Sarkome.)
Die häufig vielschichtigen Epithelzellen grenzen Körpergewebe nach innen und nach außen hin ab.
Sehr einfach kann man das anhand von Blutgefäßen (z. B. Arterien) erklären, die nach innen die sogenannte Endothelschicht (spezialisierte Epithelzellen) aufweisen, die die Blutgefäße vom Blut abgrenzen.
Daher findet man das Epithelgewebe in nahezu jedem Organ – somit liegt auf der Hand, dass eine bösartige Veränderung dieser Zellen wahrscheinlich(er) ist.
Die Epithelzellen sind umgeben von der extrazellulären Matrix (EZM), darunter auch sogenannte Fibroblasten des Bindegewebes. Als EZM bezeichnet man den Raum um eine Zelle.
Diese Fibroblasten können sich zunächst frei bewegen und regulieren nicht nur das Bindegewebe (als Teil der EZM) an sich, sondern haben auch regulatorischen Einfluss auf das Epithelgewebe. Genauer: Die EZM, somit auch diese Fibroblasten, regulieren das Wachstum der Epithelzellen.
Als Beispiel: Deine Haut regeneriert nicht, weil Hautzellen per se einfach so wachsen, sondern weil die EZM der Haut entsprechend Signale sendet, die das Wachstum der Epithelzellen anregt – die Haut wächst nicht direkt an der Oberfläche, sondern „von innen nach außen“.
„Reverse Warbug“ – der etwas andere Warburg-Effekt
Der „reverse Warburg effect“ beschreibt, dass sich Tumorzellen parasitär verhalten.
Fibroblasten der EZM verlieren im Zuge der Tumorentwicklung ein Protein namens Caveolin-1 (Cav-1). Dieses Cav-1 reguliert wesentliche Aspekte der Zellteilung und -vermehrung.
Heißt konkret, dass zunächst die Bindegewebszellen, die um die eigentliche Tumorzelle herum liegen, eine pathologische Veränderung aufweisen.
Ein Verlust von Cav-1 geht in diesen Zellen einher mit einem dramatischen Anstieg von oxidativem Stress, eine Veränderung hin zum anaeroben Stoffwechsel („Warburg-Effekt“) und einer daraus entstandenen mitochondrialen Dysfunktion, was diese Abwärtsspirale verstärkt.
Die eigentliche Tumorzelle, ausgehend vom Epithel, verhält sich dabei raffiniert, nutzt diese Veränderung aus und oxidiert die anfallenden Substrate aus dem fehlgeleiteten Stoffwechsel der Fibroblastenzellen, namentlich Pyruvat und Laktat, beides Abbauprodukte des Kohlenhydratstoffwechsels.
Der Punkt ist allerdings, dass die Tumorzelle des Epithels keinen anaeroben, sondern einen aeroben Stoffwechsel aufweist und sich von den (anaeroben) Fibroblasten lediglich beliefern lässt.
Diese Tumorzelle kann somit alle Substrate, die potenziell verwertbar sind (also Glukose, Laktat, Aminosäure, Ketone und Fettsäuren) verwenden, um sich im Körper entsprechend zu verteilen (Metastasierung).
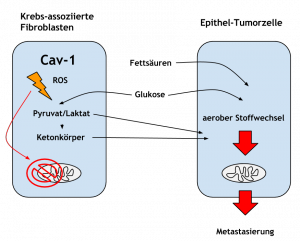
Somit ist die grundlegende Aussage von Warburg nicht mehr haltbar und muss entsprechend angepasst werden: Der Warburg-Effekt findet nicht in den Krebszellen an sich statt, sondern in den „Unterstützer-Zellen“ der Mikroumgebung der Tumorzelle, also in Fibroblasten.
Die Tumorzelle würde sich folglich nicht bösartig verändern, wenn die Mikroumgebung keinen Cav-1-Verlust, was einhergeht mit oxidativem Stress und mitochondrialer Dysfunktion, zeigen würde.
Tatsächlich wurde gezeigt, dass der Cav-1-Verlust und somit die Tumorinitiation nicht stattfindet, wenn man Antioxidantien wie N-Acetyl-Cystein (NAC) oder Quercetin gibt (Martinez-Outschoorn, 2010). Es wird postuliert, dass die Tumorzelle selbst Radikale (reactive oxygen species, ROS) produziert, um diese Fibroblasten zu „versklaven„, was den Prozess des fehlgeleiteten Zellstoffwechsels vorantreibt.
Die antioxidative Kapazität des Organismus könnte somit in ein neues Licht rücken und, im Zusammenhang mit Krebs, Aussagen wie „Antioxidantien sind nutzlos“ eindeutig widerlegen.
Auffallend sind zwei der folgenden Marker, die in direktem Zusammenhang mit oxidativem Stress, mitochondrialer Dysfunktion und Krankheitsentwicklung stehen:
- 3-Hydroxybutyrat (ein Ketonkörper)
- ADMA (Asymmetrisches Dimethylarginin)
Beide Substanzen liegen in der Krankheitsprogression (dieses Krebsmodells) massiv gesteigert im Blut vor.
Interessant ist, dass Tumor-assoziierte Fibroblasten, also die „Unterstützer-Zellen“ der eigentlichen Tumorzelle des Epithels, Ketonkörper selbst produzieren können. Sie können sie aber nicht selbst verwerten – dies bleibt den Epithelzellen vorbehalten, die eine gesteigerte Expression von Enzymen aufweisen, die Ketonkörper-Abbau beteiligt sind.
Auch hier wird deutlich, dass Tumor-assoziierte Fibroblasten die eigentliche Tumorzelle mit Substraten „nährt“.
ADMA blockiert das für die Stickstoffmonoxid-Produktion essentielle Enzym namens eNOS. Edubily-Leser sollten sich hier auskennen. Stickstoffmonoxid, kurz NO, ist enorm wichtig, auch und gerade bei der Krebsprävention.
ADMA blockiert („entkoppelt„) das Enzym eNOS, so dass kein NO entsteht, sondern freie Radikale (reactive oxygen species, ROS), die den oxidativen Stress der Tumor-assoziierten Fibroblasten verstärken, um die für den Tumor förderliche Mikroumgebung aufrechtzuerhalten.
Sowohl ADMA, als auch ß-Hydroxybutyrat stellen verlässliche Marker dar, um einen Cav-1-Verlust, das im direkten Zusammenhang mit der Tumoraggressivität steht, zu diagnostizieren. Deshalb sollen sie – laut Autoren – in der klinischen Praxis genutzt werden, um einen bösartigen Tumor frühzeitig zu erkennen.
Eine Hypothese der Autoren besagt, dass die in den Fibroblasten gebildeten Ketonkörper als superfuel (= Supertreibstoff) für die Tumorzellen dienen. Denn Ketonkörper können in Relation zum Sauerstoffbedarf deutlich effizienter genutzt werden, um ausreichend Energie zu produzieren.
In Anbetracht der Sauerstoff-unterversorgten Tumorumgebung macht das Sinn. Ketonkörper werden in den Krebs-assoziierten Fibroblasten vermutlich nicht mit Hilfe der ß-Oxidation (Fettverbrennung) synthetisiert, sondern aus Pyruvat, als Endprodukt des Kohlenhydratstoffwechsels. Auch diese Tatsache macht Sinn in Anbetracht der mitochondrialen Dysfunktion der Cav-1-negativ-Fibroblasten.
Tatsächlich scheinen Ketonkörper auch deshalb verlässliche Substrate zu sein, da sie direkt via sogenannte MCT-Transporter zwischen den Krebs-assoziierten Fibroblasten und den Tumorzellen ausgetauscht werden können.
Aus dieser Sicht erscheint das Anwenden einer ketogenen Diät als Krebsprävention eher unvorteilhaft. Denn ursprünglich ging man davon aus, dass die gesteigerte Krebsrate bei Diabetes-Erkrankten aufgrund des womöglich erhöhten Blutzuckers zu beobachten ist.
Tatsächlich aber fallen in Diabetikern, genau wie in Insulinresisten, konstant vermehrt Ketonkörper an. Dies ist wenig verwunderlich, ist Typ-2-Diabetes und Zustand einer Insulinresistenz doch fast nahezu immer gekoppelt an eine Dysfunktion des Fettgewebes (häufig aufgrund einer zu großen Fettmasse), wobei das Fettgewebe konstant zu viele Fettsäuren abgibt, was in gesteigerter Ketonkörper-Produktion resultiert.
Offensichtlich liegt dies auch nicht an der Kombination aus Glukose und Ketonkörpern, denn man weiß schon seit fast 30 Jahren, dass fastende Ratten eine dramatisch gesteigerte Tumorprogression aufweisen. Wir erinnern uns bitte, dass ketogene Diäten das Fasten mimen sollen. Doch dazu gleich mehr
(Vgl. Pavlides, 2010)
- Martinez-Outschoorn und Kollegen (2012) zeigten, dass eine genetische Veränderung von Fibroblasten und Epithelzellen des Brustgewebes, das eine klassische Krebssituation mimen soll, eine dramatisch gesteigerte Tumorprogression herbeiführt durch die gesteigerte Utilisation von Ketonkörpern
- Die von Anhängern der ketogenen Diät kritisierte Bonuccelli-Studie (2010) zeigte extakt dasselbe: Laktat und Ketonkörper stimulieren massiv das Wachstum von Krebszellen. Diese Arbeit wurde kritisiert, weil die Wissenschaftler keine ketogene Diät imitierten, denn sie nutzen auch Glukose im Medium. Bemerkenswert hier ist, dass die Autoren stark davor warnen, Krebspatienten mit Laktat via Laktatdrinks zu versorgen: Laktat stimulierte die Metastasierung der Lunge 10fach (Anmerkung: Es gibt einen sehr bekannten deutschen Arzt, der Laktatdrinks verkauft)
- Ähnliches wurde am Eierstockkrebs gezeigt, veröffentlicht im bekannten Nature-Journal: Die aus dem Fettgewebe freigesetzten Fettsäuren speisen das Krebswachstum und insbesondere die Metastasierung, denn das Hemmen von Fettsäure-bindenden-Proteinen, die die Fettsäureaufnahme in Zellen ermöglichen, senkte die Metastasierungsrate dramatisch (Nieman, 2011). Bedenken wir bitte, dass es für die Tumorzelle keinen Unterschied macht, ob die Fettsäure aus der Nahrung oder aus dem Fettgewebe kommt
Bitte beachten, dass sich dieser Effekt auf die Mehrzahl der Krebserkrankungen bezieht, die von kranken Epithelzellen ausgehen. Es bleibt also offen, inwieweit diese Beobachtungen für Tumor des Gehirns, als Beispiel, gelten.
Sauer-Experimente: Beim Fasten wächst der Tumor schneller
Tumore können viele Substrate oxidieren
Both ketone bodies were utilized by the tumors, and the rates of utilization were directly related to the rates of supply.
An average of 52% of the acetoacetate and 30% of the ß-hydroxybutyrate carried in the arterial blood was removed during one pass through the tumors.
The concentrations of glucose and glutamine in the arterial whole blood of fasted tumor-bearing rats […] both of these substrates were utilized at rates that were directly proportional to the rates of supply.
Thirty-six % of the glucose and 25% of the glutamine supplied to the tumors was utilized. Comparison (by linear regression and analysis of covariance) of the rates of supply and utilization of glucose and glutamine in tumors growing in fasted versus fed rats indicated that these substrates are utilized more efficiently by tumors growing in fasted animals.
The results indicate that energy production for tumor growth in fasted rats is supported, in part, by an increased availability of ketone bodies, by an increased efficiency of utilization of glucose and glutamine, and, under certain circumstances, by utilization of lactic acid.
(Sauer, 1983)
Sauer und Kollegen fanden schon 1983 heraus, dass Tumore nicht nur vom Warburg-Effekt leben. Sie studierten die Tumorentwicklung in normalen und in fastenden Ratten:
- Beide Ketonkörper wurden verarbeitet, diese Aufnahme und Verarbeitung war direkt proportional zur Verfügbarkeit
- 52 % und 30 % (Acetoacetat und ß-Hydroxybutyrat) werden vom Tumor beim einmaligen Passieren vom Tumor aufgenommen
- Glutamin (eine Aminosäure) und Glukose wurden verarbeitet, diese Aufnahme war direkt proportional zur Verfügbarkeit
- 36 % und 25 % (Glukose und Glutamin) wurden beim einmaligen Passieren vom Tumor aufgenommen
- Diese Substrate werden deutlich effizienter aufgenommen im Fastenzustand
- Das beschleunigte Wachstum von Tumoren im Fastenzustand könnte mit einer erhöhten Bereitstellung von Ketonkörpern und einer effizienteren Nutzung von Glukose und Glutamin zu erklären sein
Sauer beschreibt in dieser Arbeit, dass Ketonkörper in 37 von 38 Tumoren verarbeitet wurden. Vor allem in Tumorzellen der Leber wurde eine rasche Verwertung von Ketonkörpern festgestellt. Bemerkenswert ist, so die Autoren, dass die Tumore Ketonkörper gut verwerten, trotz der Beobachtung, dass die Enzym-Aktivität deutlich niedriger ist als in gesunden Zellen.
Die Autoren machten auch noch eine andere Beobachtung, die die Warburg-Hypothese schon damals in Frage stellte: 50 % der untersuchten Tumore konnten Laktat verarbeiten, aber produzierten selbst sehr wenig Laktat, darunter auch ein sehr rasch wachsender Lebertumor, der eigentlich große Mengen Laktat produzieren müsste als Endprodukt des anaeroben Traubenzucker-(Glukose-)Stoffwechsels.
In fastenden Tieren wurde außerdem beobachtet, dass der Tumor deutlich effizienter wird bezüglich der Glukose-Verwertung: Unabhängig von der Glukose-Zufuhr steigerte der Tumor die Glukose-Verarbeitungsrate, trotz der Tatsache, dass der Blutzuckerspiegel knapp 12 % niedriger war.
Ähnlich der gesteigerten Glukose-Utilisation im Fastenzustand, war auch die Glutamin-Utilisation im Fastenzustand gesteigert.
Die Tumore fastender Ratten sind 3-4fach größer
Sauer und Kollegen beobachteten aber nicht nur, dass Tumore generell Ketonkörper nutzen können, sondern auch, dass Tumore im Fastenzustand eine 3-4fach erhöhte Wachstumsrate aufweisen. (Vgl. Sauer, 1986)
Diese beschleunigte Wachstumsrate blieb aus, sobald das Tier normal gefüttert wurde. Die „standard chow“ von Ratten beinhaltet einen sehr hohen Anteil an Maisstärke, also Kohlenhydraten.
Bemerkenswert ist, dass diese gesteigerte Wachstumsrate des Tumors nicht zu beobachten war, wenn die Fettspeicher des Tieres geleert wurden und entsprechend weniger freie Fettsäuren zur Verfügung standen. Daher schlussfolgerten Sauer und Kollegen, dass der Tumor zum Wachstum auf Fettsäuren angewiesen ist.
Die Tiere mit leeren Fettzellen zeigten keinerlei Anstieg von freien Fettsäuren und Ketonkörpern während des Fastens.
(Weiterführend: Sauer, 1987/1987)
Wann helfen ketogene Diäten?
Ersichtlich wurde, dass eine vereinfachte Darstellung des Tumorstoffwechsels („Man kann den Krebs aushungern“) nicht zielführend und gewinnbringend sein kann. Eine vereinfachte Ernährungsempfehlung auszusprechen kann für keinen Beteiligten zufriedenstellend sein, sofern nicht eindeutig klar ist, wie der Tumor sich metabolisch verhält.
Fakt ist aber, dass die Datenlage zeigt, dass ketogene Diäten auch helfen können. Dies muss nicht zwingend daran liegen, dass Tumore auf eine Glukose-Versorgung angewiesen sind.
Denn es muss klar sein, dass das Praktizieren einer ketogenen Diät einhergeht mit der Induktion einer physiologischen Insulinresistenz. Entgegen gängiger Auffassung, bin ich mir im Klaren darüber, dass diese Form der Insulinresistenz keine pathologische Veränderung darstellt, sondern zwangsläufig notwendig ist, um Glukose „zu sparen“ („glucose sparing„), unter anderem damit der Blutzuckerspiegel stabil bleibt.
In der Tat fällt der Blutzuckerspiegel während einer ordentlich praktizierten ketogenen Diät nicht deutlich ab, sondern hält sich stabil. Es kann sogar so sein, dass der Blutzuckerspiegel einen höheren Wert annimmt.
So ist es nicht selten der Fall, dass der Langzeitblutzucker, HbA1c, sogar steigt während einer ketogenen Diät. Dies ist, wie gesagt, keine pathologische Veränderung und für den Großteil der Praktizierenden kein Problem.
Problematisch wird diese Tatsache allerdings, wenn man mit ketogenen Diäten Krebszellen „aushungern“ möchte. Als Argument soll dienen, dass keine Glukose vorhanden ist, wenn wir keine Glukose zuführen. Dies ist, wie beschrieben, schlicht falsch und zu vereinfacht, was klar wird anhand der Ausführung.
Häufig werden Daten falsch interpretiert und nicht in den richtigen Kontext gesetzt. Es ist richtig: Viele Studien zeigen, dass ein Gewichtsverlust, herbeigeführt durch eine hypokalorische (= weniger Kalorien zugeführt als verbraucht) ketogene Diät, zu einer verbesserten Blutzuckerkontrolle bzw. zu einem besseren Blutzuckerspiegel führen kann. Dies passiert insbesondere dann, wenn man Diabetes-Patienten oder Insulinresistente (metabolisches Syndrom) untersucht. Man sollte dabei allerdings beachten, dass viele Menschen nicht unter diesen Problemen leiden, weswegen man auch nicht davon ausgehen kann, dass ein normaler Blutzuckerspiegel noch deutlicher gesenkt werden kann.
Die Datenlage
Doch wie sieht die Datenlage aus? Gibt es Studien, die zeigen, dass ketogene Diäten helfen können?
- Eine KD (bei 90 % Fettanteil) in Mäusen verlangsamt das Tumorwachstum bzw. die Metastasierung, steigert die Lebensspanne um 57 %. Beobachtet wurde ein deutlich niedrigerer Blutzuckerspiegel (fast 1/3 niedriger). Verstärkt wurden diese Effekte durch hyperbare Oxygenierung (= Sauerstoffzufuhr). Verwendet wurden spezielle Tumorzellen, die extrem aggressiv sind und immer zum Tode führen (Poff, 2013)
- Eine KD (bei 80 % Fettanteil unterstützt durch das Produkt KetoCal) in Mäusen hemmt das Wachstum von Gehirntumoren um 35 – 65 %, allerdings nur dann, wenn die Kalorien eingeschränkt wurden. Der Blutzuckerspiegel war über 40 % niedriger in der Keto-plus-Restriktionsgruppe – eine KD alleine senkte den Blutzuckerspiegel um circa 12 % (Seyfried, 2008).
- Eine KD verlangsamt das Wachstum eines Lungentumors in Mäusen (bei 90 % Fettanteil), aber nur wenn kombiniert mit Strahlung. Eine ketogene Diät alleine hilft nicht. In Zellkulturen wurde gezeigt, dass diese Tumore auch ß-Hydroxybutyrat als Energiequelle nutzen können (Allen, 2013).
- Das Tumorwachstum des Plattenepithels der Haut wird dramatisch verlangsamt (= halbiert) durch eine Kohlenhydrat-arme Diät (15 %), die 60 % Protein enthält, da (laut den Autoren) eine „high fat diet“ das Tumorwachstum beschleunigt. Dies war noch erfolgreicher, wenn man den Kohlenhydratanteil auf 10 % senkte. Diese Ernährung senkte Laktat-, Insulin- und Glukose-Spiegel. In einem anderen Modell, das Brustkrebs mimen soll, wurde gezeigt, dass 7 von 10 spontan Tumore entwickeln, während in der KH-armen Gruppe nur 3 von 11 Tiere Tumore entwickeln und auch signifikant länger leben als erkrankte Tiere in der Kontrollgruppe. Bemerkenswert ist, dass in diesen Tieren keine Ketonkörper nachgewiesen wurden. Weiterhin schreiben die Autoren, dass ein solch dramatischer Abfall des Blutzuckerspiegels (wie gesehen bei Nagern) beim Menschen nicht zu erwarten ist. Wenn man bei Diabetikern Nahrungsmitteln mit niedrigem glykämischen Index wählt, dann können die Blutzuckerspitzen nach KH-Mahlzeiten um 40 % gesenkt werden – eine Zahl, die bei Mäusen erreicht wird, nach einer Kohlenhydratreduktion. Allerdings geht man hier von zwei verschiedenen Ausgangspunkten aus (pathologisch vs. normale Blutzuckerspiegel) (Ho, 2011)
Falls du noch mehr Studien zu diesem Thema kennst, dann kannst du sie gerne per Mail schicken. Ich habe die Studiendatenbank sehr sorgfältig untersucht. Zum einen gibt es nicht so viele Studien – wie man sich das womöglich vorstellt – zu diesem Thema, zum anderen trifft man sehr häufig auf eine Kombination aus KD und Kalorienrestriktion oder KD und Chemo- bzw. Strahlentherapie.
Auch beim Menschen kein erhoffter Durchbruch
Im Dezember 2014, also vor einigen Monaten, erschienen die Ergebnisse der ERGO-Studie, an der auch Dr. Coy und Ulrike Kämmerer beteiligt waren.
Dies war eine sogenannte Pilot-Studie, an der 20 Krebspatienten mit bösartigen Gehirntumor teilnahmen.
In the mouse glioma model, ketogenic diet alone had no effect on median survival, but increased that of bevacizumab-treated mice from 52 to 58 days (p<0.05). In conclusion, a ketogenic diet is feasible and safe but probably has no significant clinical activity when used as single agent in recurrent glioma. Further clinical trials are necessary to clarify whether calorie restriction or the combination with other therapeutic modalities, such as radiotherapy or anti-angiogenic treatments, could enhance the efficacy of the ketogenic diet.
(Rieger, 2014)
Die Autoren schreiben, dass eine ketogene Diät selbst keinen Einfluss auf eine Tumorprogression beim Mausmodell eines Glioblastoms (bösartiger Gehirntumor) hatte, zusammen mit einem Antikrebs-Medikament die Lebensspanne allerdings verlängerte.
Auch am Menschen wurden keine Erfolge erzielt, wenngleich die KD sicher und feasible, also praktikabel, ist.
Die Autoren wollen nun testen, ob die Effizienz einer KD gesteigert werden kann in Verbindung mit anderen Behandlungsmethoden (z. B. Strahlentherapie) oder Kalorienrestriktion.
Fazit und Ausblick
Mein Anliegen war es, einen Einblick in die Faktenlandschaft zu ermöglichen und zu zeigen, wie verschwommen das Bild eigentlich ist, das eine ketogene Diät im Zusammenhang mit einer Krebsprävention darbietet.
So möchte ich klar zum Ausdruck bringen, dass dieser Artikel keinerlei Ansicht vertritt.
Zusammenfassend lässt sich allerdings sagen, dass eine ketogene Diät keine Wunderheilung garantiert und bieten kann. Es müssen in Zukunft Methoden geschaffen werden, die eine metabolische Typisierung eines Tumors rasch und zielführend ermöglichen, sodass man selbst gezielt und nachhaltig seinen Lebensstil entsprechend anpassen kann.
Bis dahin würde ich mich stark davon distanzieren, jedem zum Praktizieren einer ketogenen Diät zu raten, völlig ungeachtet der Tumorart bzw. -spezifität.
Vielversprechende Forschungansätze konnten am Menschen bisher nicht gezeigt werden, zumindest am Beispiel des bösartigen Gehirntumors.
Oben aufgelistet findet sich eine sehr vielversprechende Arbeit, bei der allerdings weder Ketonkörper entstanden sind, noch in Betracht gezogen wurde, dass ein Proteinanteil von 60 % nicht auf den Menschen zu übertragen ist, dies schlicht unmöglich wäre.
Allerdings geben die Arbeiten Hinweise darauf, dass ein abnorm erhöhter Blutzuckerspiegel eine Tumorprogression begünstigen kann.
Was bleibt ist: Jegliche Einschränkung eines für das Tumorwachstum verantwortliche Substrat (z. B. Fettsäuren oder Kohlenhydrate, aber auch Glutamin) kann letztendlich zu einer Einschränkung des Wachstums desselben führen.
Referenzen
Allen, B. G.; Bhatia, S. K.; Buatti, J. M. u. a. (2013): „Ketogenic Diets Enhance Oxidative Stress and Radio-Chemo-Therapy Responses in Lung Cancer Xenografts“. In: Clinical Cancer Research. 19 (14), S. 3905-3913, DOI: 10.1158/1078-0432.ccr-12-0287.
Berg, Jeremy M; Tymoczko, John L; Stryer, Lubert (2002): Biochemistry. New York: W. H. Freeman and Co.
Bonuccelli, Gloria; Tsirigos, Aristotelis; Whitaker-Menezes, Diana u. a. (2010): „Ketones and lactate “fuel” tumor growth and metastasis“. In: Cell Cycle. 9 (17), S. 3506-3514, DOI: 10.4161/cc.9.17.12731.
Hall, John E; Guyton, Arthur C (2006): Guyton & Hall physiology review. Philadelphia: Elsevier Saunders.
Ho, V. W.; Leung, K.; Hsu, A. u. a. (2011): „A Low Carbohydrate, High Protein Diet Slows Tumor Growth and Prevents Cancer Initiation“. In: Cancer Research. 71 (13), S. 4484-4493, DOI: 10.1158/0008-5472.can-10-3973.
Martinez-Outschoorn, Ubaldo E.; Balliet, Renee M.; Rivadeneira, Dayana u. a. (2010): „Oxidative stress in cancer associated fibroblasts drives tumor-stroma co-evolution“. In: Cell Cycle. 9 (16), S. 3276-3296, DOI: 10.4161/cc.9.16.12553.
Martinez-Outschoorn, Ubaldo E.; Lin, Zhao; Whitaker-Menezes, Diana u. a. (2012): „Ketone body utilization drives tumor growth and metastasis“. In: Cell Cycle. 11 (21), S. 3964-3971, DOI: 10.4161/cc.22137.
Nieman, Kristin M; Kenny, Hilary A; Penicka, Carla V u. a. (2011): „Adipocytes promote ovarian cancer metastasis and provide energy for rapid tumor growth“. In: Nat Med. 17 (11), S. 1498-1503, DOI: 10.1038/nm.2492.
Pavlides, Stephanos; Tsirigos, Aristotelis; Migneco, Gemma u. a. (2010): „The autophagic tumor stroma model of cancer“. In: Cell Cycle. 9 (17), S. 3485-3505, DOI: 10.4161/cc.9.17.12721.
Poff, Angela M.; Ari, Csilla; Seyfried, Thomas N. u. a. (2013): „The Ketogenic Diet and Hyperbaric Oxygen Therapy Prolong Survival in Mice with Systemic Metastatic Cancer“. In: PLoS ONE. 8 (6), S. e65522, DOI: 10.1371/journal.pone.0065522.
Rieger, Johannes; Bähr, Oliver; Maurer, Gabriele u. a. (2014): „ERGO: A pilot study of ketogenic diet in recurrent glioblastoma“. In: International Journal of Oncology., DOI: 10.3892/ijo.2014.2382.
Sauer, Leonard A, and Robert T Dauchy. „Ketone body, glucose, lactic acid, and amino acid utilization by tumors in vivo in fasted rats.“ Cancer research 43.8 (1983): 3497-3503.
Sauer, Leonard A et al. „Stimulation of tumor growth in adult rats in vivo during an acute fast.“ Cancer research 46.7 (1986): 3469-3475.
Sauer, Leonard A, and Robert T Dauchy. „Stimulation of tumor growth in adult rats in vivo during acute streptozotocin-induced diabetes.“ Cancer research 47.7 (1987): 1756-1761.
Sauer, Leonard A, and Robert T Dauchy. „Blood nutrient concentrations and tumor growth in vivo in rats: relationships during the onset of an acute fast.“ Cancer research 47.4 (1987): 1065-1068.
Seyfried, Thomas N.; Kiebish, Michael; Mukherjee, Purna u. a. (2008): „Targeting energy metabolism in brain cancer with calorically restricted ketogenic diets“. In: Epilepsia. 49 , S. 114-116, DOI: 10.1111/j.1528-1167.2008.01853.x.
16 comments On Ketogene Diät in der Krebsbehandlung
Ein toller Artikel.
Ich bin selbst vor 3,5 Jahren an Darmkrebs operiert worden. Statt adjuvanter Chemo wählte ich die ketogene Ernährung nach Prof. Kämmerer. Ich bin bis heute rezidiv- und metastasenfrei, habe mir aber eine paar andere, möglicherweise ernährungsbedingte, Zipperlein eingefangen, u.a. eine SD-Unterfunktion, die schon recht ungemütlich ist. Ich beginne jetzt, nachdem ich auch deine Artikel über die Funktion der SD gelesen habe, die KH wieder in den Bereich einer low carb Ernährung zu bringen. Dieser Artikel hier unterstützt mich ein wenig in dieser Absicht. Besonders toll, dass du ihn wertungsfrei verfasst hast.
Es würde mich jedoch interessieren, wer die Studien von Sauer in Auftrag gegeben hat. Weißt du das zufällig?
Vielen Dank für diesen Artikel, ich freu mich auf weitere.
Sonnige Ostertage wünscht
Heike
Hi Heike,
das freut mich sehr.
Das, was mir am wichtigsten ist: die Differenzierung. Dinge müssen von möglichst vielen Seiten beleuchtet werden. Wenn ketogene Diäten bei bestimmten Erkrankungen helfen, dann sollen sie unbedingt zu therapeutischen Zwecken genutzt werden. Unbedingt beachten muss man allerdings, dass es eben auch Schattenseiten gibt.
An dieser Stelle wünsche ich dir schon mal alles Gute für dein weiteres Vorgehen.
Nein, ich weiß nicht wer die Studien in Auftrag gegeben hat, aber Sauer publiziert nahezu bis heute über diverse Umwelteinflüsse, die das Tumorwachstum beeinflussen. Seine Veröffentlichungen kann man hier einsehen: http://www.ncbi.nlm.nih.gov/pubmed/?term=Sauer+LA%5BAuthor%5D
LG Chris
Vielen Dank für den Denkanstoss, habe nach genauer Betrachtung meiner 13-jährigen BK-History mit Lebermetastasen festgestellt, dass sich nach nunmehr 1,5 Jahren ketogener Ernährung eher vermehrtes Meta-Wachstum eingestellt hat, was ich allerdings nicht mit der Ernährung in Verbindung gebracht habe.Werde zunächst zu Low Carb zurückgehen und sehen, was passiert. Dein Artikel wird zur Zeit auch heftig in der Keto-bei-Krebs Guppe diskutiert! Liebe Grüße und ein paar Sonnenstrahlen zu Ostern, Gaby
Hey Gaby,
vielen Dank für das Schildern deiner Erfahrungen. Äußerst interessant, wenngleich auch erschütternd – ich wünsche dir an dieser Stelle alles Gute!
Was mir auffällt ist, dass viele Patienten oder an einer Prävention interessierten Menschen sich nicht mit Primärquellen befassen. Daraus erwächst sehr häufig der Eindruck, dass eine ketogene Diät extrem vielversprechend ist, einhergehend mit der Frage, wieso eine KD noch nicht als klinische Behandlung eingesetzt wird.
Dabei wird häufig die Datenlage nicht gesehen (siehe Artikel) und auch ein falsches Bild generiert – so sind die Daten von beispielsweise Dr. Coy weit weniger schlüssig, als man vermuten könnte und die von anderen Wissenschaftlern geäußerte Kritik wird generell als Widerstand angesehen.
Wenn man sich allerdings objektiv mit der Materie auseinandersetzt, wird rasch klar, dass das Bild nicht einheitlich, sondern hoch uneinheitlich ist und man keine Pauschalaussage bezüglich Ernährungsempfehlungen als Behandlung oder Prävention tätigen kann, sofern eine metabolische Typisierung nicht eindeutig gezeigt hat, wie sich der Tumor bzw. der Krebs verhält.
Wie gesagt: Alles Gute dir und erholsame Feiertage.
LG, Chris
Hi Chris,
einfach großartig! Vielen Dank!
Viele Grüße und schöne Feiertage,
Pawel
Hey Pawel,
vielen Dank, dasselbe wünsche ich dir und deiner Familie auch :-)
LG, Chris
Der stärkste Artikel, den ich von dir gelesen habe.
Finde ich richtig gut.
Hey Sascha,
freut mich sehr, dass dir der Artikel gefällt. Ich hoffe, dass wir das in Zukunft so fortsetzen können :-)
Beste Grüße
Hi Chris,
vielen Dank für den Artikel.
Bei meinem Vater (71 J) wurde leider vor ein Paar Tagen Bronchialkarzinom diagnostiziert. Derweil wohl ohne Metastasenbildung. Wie es weiter geht, steht noch nicht fest. Wie schätzst du die Chancen einer Keto-Ernährung bei dieser Krebserkrankung? Ich erwarte selbstverständlich keine belastbare Aussage, aber vielleicht hast du irgendwo gelesen, welche Krebsarten eher und welche weniger auf Keto-Ernährung ansprechen (z.B. Prostatakrebs eher weniger).
Mal eine andere Frage, die mich im Zusammenhang mit Fett beschäftigt. Du schreibst immer wieder, man solle große KH-Mengen nicht mit großen Fett-Mengen gleichzeitig verzehren (Stichwort: Insulin = Speicherhormon). Andererseits schreibst du aber immer wieder, dass Fette erst in die Zellen gespeichert werden müssen, damit freie Fettsäuren für die ß-Oxidation zur Verfügung stehen (von den im hiesigen Artikel genannten Ausnhamen abgesen). Wie passt das zusammen? Wahrscheinlich übersehe ich hier eine wichtige „Klenigkeit“ und wäre dir für die Aufklärung dankbar.
@Matthias Bachmann: Vit C-Infusionen: wie / wo / welche Dosierungen? Wie konntest du die schulmedizinisch geprägten Ärzte davon überzeugen? Vielen Dank im Voraus!
Viele Grüße und frohe Ostern
Peter Buchmann
Hey Peter,
leider traue ich mir diesbezüglich keine Aussage zu.
Bezogen auf Fett: Der Stoffwechsel von Fettzellen, insbesondere die Verarbeitung nach Aufnahme von Triglyceriden (Nahrung) ist nicht eindeutig geklärt.
Insulin reguliert Muskel- und Fettzellen-Lipoproteinlipase (= Enzym, das für die Fettsäurespaltung zuständig ist). Du hast *immer* deutlich mehr Fettzellen-LPL, als Muskel-LPL, da sonst die Gefahr besteht, dass man rasch Insulin-resistent wird.
Allerdings verschiebt sich dieses Verhältnis etwas zugunsten von mehr Muskel-LPL während Phasen, in denen Insulin niedrig(er) ist.
Daher sage ich vereinfacht, dass Triglyceride den Umweg über das Fettgewebe nehmen, um dann entsprechend als freie Fettsäuren (und somit als Energiequelle) zur Verfügung zu stehen.
Wie eingangs geschrieben, ist die Fettaufnahme in Fettzellen noch nicht eindeutig geklärt, so scheint es auch Mechanismen außerhalb von LPL zu geben, die eine Triglycerid-„clearance“ ermöglichen.
Alles Gute für deinen Vater!
LG, Chris
Hallo Peter,
tut mir leid, dass dein Vater von dieser Krankheit betroffen ist.
Wie Chris schon schrieb, wird die KH-reduzierte Ernährung hauptsächlich durch Frau Prof. Kämmerer von der Uniklinik Würzburg sowie Dr. Coy http://www.johannescoy.de/ propagiert. In meinem Fall war aber diese Ernährungsform nur Teil einer komplexen alternativen Behandlung. Mein Behandler, ein auf Krebserkrankungen spezialisierter Heilpraktiker, ist leider inzwischen verstorben und die Praxis aufgelöst. Ich selbst bin nicht im Besitz von Behandlungsunterlagen.
Wenn dein Vater an einer entsprechenden Behandlung interessiert ist findet ihr bestimmt weitere Anhaltspunkte auf der Seite von Dr. Coy.
Alles Gute und ein schönes Osterfest wünscht
Matthias Bachmann
Sehr gehaltvoller Artikel.
Vor allem ohne Wertung, was ich sehr gut finde. Nüchtern Fakten gegenübergestellt ohne „personal interest“. Klasse!
Es wäre zu schön, wenn es so einfach wäre mit der ketogenen Diät. Nicht ganz ohne Grund hat Sie bisher eben keinen Einzug gehalten in die Standardtherapie onkologischer Erkrankungen.
Auch zu bemerken ist, dass der Körper prinzipiell um einen konstanten Blutzuckerspiegel bemüht ist. D.h. die konstanten 70-90 mg/dl, die auch im Fastenzustand je nach Person aufrecht erhalten werden, reichen, in Kombination mit den Ketonen wie ja oben gezeigt, der Krebszelle völlig aus. Ob ein mehr an Glucose durch KH-reiche Kost auch ein „mehr“ an Tumorwachstum erzeugt, darf gemäß der obigen Daten bezweifelt werden.
Das ist wie mit dem Prostata-Ca und dem Testosteron: es reichen bereits sehr! geringe Spiegel an Testosteron, um die Rezeptoren abzusättigen. Ein „mehr“ an T schadet nicht, kann nicht schaden, weil ohnehin alle Rezeptoren bei geringen Mengen besetzt sind. Im Gegenteil, hat ein mehr in Bezug auf andere Organe (Hirn, Muskeln, Knochen) eher nützliche Effekte und wirkt ein höherer T-Spiegel womöglich eher protektiv gegenüber dem Prostata-Ca.
Krebs hat zig Ursachen….eine Lösung kann es für 1000ende Gründe daher nicht geben.
Hey Doc,
freut mich, dass du zufrieden damit bist. Ich habe mir fest vorgenommen, in Zukunft vermehrt Evidenz-basiert zu schreiben, so dass sich jeder selbst eine möglichst objektive Meinung von Sachverhalten bilden kann, ohne, dass es vorher großartig durch den „Chris-Filter“ gelaufen ist.
Deiner Ausführung kann ich mich nur anschließen. Wenn man den HbA1c-Wert als Referenz nimmt, dann wird rasch klar, dass eine ketogene Diät nicht so viele Vorteile bringt bezogen auf „Krebszellen aushungern“ (abgesehen von der Tatsache, dass Tumorzellen nicht immer nur präferiert Glukose verstoffwechseln). In diesem Zusammenhang finde ich auch interessant, wie der Körper auf die Zufuhr von verschiedenen Substraten reagiert, z. B. bei erhöhter KH-Zufuhr entsprechend auch eine bessere Insulinsensitivität, falls derjenige metabolisch flexibel bzw. gesund ist. So versucht er natürlich das Gleichgewicht zu halten.
Ansonsten: Die „1000 Gründe“ stimmen leider.
LG, Chris
Hallo Chris,
danke für diesen wieder mal absolut super recherchierten Artikel! Wo nimmst du nur immer
die Zeit dafür her?
Genau dieses Thema beschäftigt mich seit 5 Jahren nach einem operierten Magen-Ca.
Anschließend keine Chemo, sondern Therapie nach Dr. Coy, ( ca. 70g KH/Tag bei 63kg
Körpergewicht). Desweiteren orthomolekulare Medizin, u.a. Quercetin, Curcuma,
Vit. C-Infusionen, Chrompicolinat, rechtsdrehende Milchsäure Vit. D3 usw. usw.
Im Ergebnis bisher kein Rezidiv, was auch so bleiben soll !!! Was jetzt für diesen positiven
Verlauf ursächlich war wird man wohl nicht nachvollziehen können.
Probleme macht mir derzeit mein Typ 2 Diabetes. Trotz unveränderter Ernährung (KH-reduziert)
HbA1c von 6,3 auf 7,3 gestiegen. Körpergewicht weiterhin konstant 63 kg bei 178cm Größe. Habe jetzt entsprechend deinem Artikel “Insulinsensivität und jungfräuliche Haut” mit der
Supplementierung von Glycin und L-Methylfolat begonnen. Hoffe auf einen bald
messbaren Erfolg.
Würde mich freuen über weitere spezielle Tipps, die vielleicht im Buch oder auf deiner Seite noch nicht nachlesbar sind.
Beste Grüße,
Matthias
Hey Matthias,
lass uns diesbezüglich lieber Mails austauschen.
Mich erreichst du unter chris@genetisches-maximum.de oder kontakt@genetisches-maximum.de
Liebe Grüße
Hervorragend!
Super ausführlich und angenehm zu lesen.