Wo wirken Jod und Selen genau?
Ist eine L-Thyroxin-Monotherapie für meine Unterfunktion doch nicht optimal?
Dies ist der zweite Teil der „Schilddrüsen-Reihe“ unseres Autors Tim. Die weiteren Artikel findest du hier:
- Teil 1: Die Schilddrüse – was sie tut und wie sie tut
- Teil 3: Schadest du unbewusst deiner Schilddrüse?
- Teil 4: Wege zur gesunden Schilddrüse
In Teil I schrieb ich allgemein von “den Schilddrüsenhormonen” und was sie so bewirken.
Das möchte ich hier in der Fortsetzung weiter spezifizieren und grundlegende Mechanismen vermitteln.
Es wird sich deshalb bewusst zeitweise recht faktenlastig lesen. Trotzdem finden sich aber auch vereinzelte Exkurse zu Diagnostik und Therapie. Ich versuche damit zum Beispiel klar zu machen , warum der Arzt diese und jene Behandlung vorschlägt. Gerade da doch recht viele Personen (insbesondere Frauen) ausschließlich mit Levothyroxin behandelt werden, werde ich zusätzlich darauf eingehen, wo die Vorteile in einer balancierten Kombinationstherapie der Schilddrüsenhormone liegen könnten.
Es wird übrigens einen zusätzlichen Teil mit ausschließlich praktischen Vorgaben geben. Auf Grund von Komplexität, Individualität und Kontextabhängigkeit versuche ich das weitestgehend zu vermeiden.
Sofern es von Chris aber zuvor “peer-reviewed” wurde, wage ich es aber einmal, einige Richtlinien zur Schilddrüsen-freundlichen Ernährung und Lebensführung zu listen.
Was geschieht in der Schilddrüse?
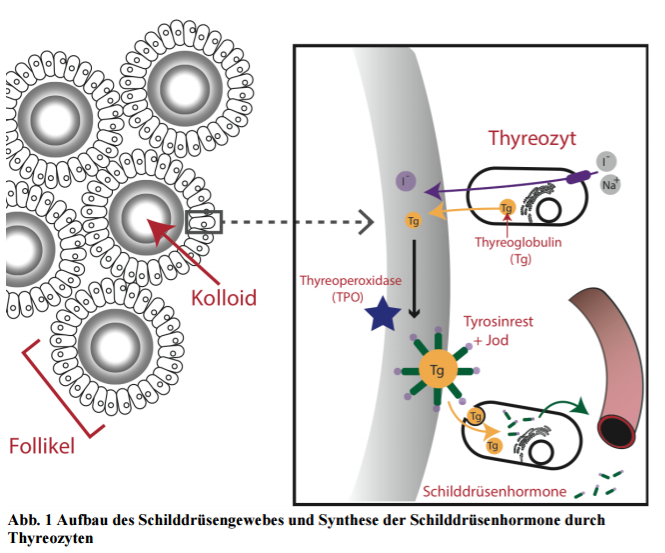
Die Schilddrüse ist eines der größten und bedeutendsten endokrinen Organe in Wirbeltieren und liegt bei Säugern schmetterlingsförmig vor der Luftröhre. Der histologische Aufbau des Schilddrüsengewebes ist äußerst speziell: Es finden sich bläschenartige Gebilde, sogenannte Follikel, welche aus einer Schicht von Thyreozyten (= Follikelepithelzellen) gebildet werden.
Diese besonderen Zellen akkumulieren große Mengen an Jodid (intrazellulär 30-40 mal mehr Jodid als im Blutserum).
Dieser Prozesse („jodide trapping“) wird über einen aktiven, ATP-abhängigen Transportmechanismus (Na/J-Symporter) vermittelt und wird von verschiedenen Faktoren reguliert.
Hochdosiertes Jodid kann diesen Transport absättigen. Gehemmt werden kann die Jodidaufnahme durch kompetitive Inhibitoren wie zum Beispiel ClO4– (Perchlorat) und TcO4–(Pertechnat).
Perchlorat wird medizinisch zum Beispiel bei einer thyreotoxischen Krise angewendet, welche sich bei Personen mit einer Überfunktion durch zusätzlichen Stress, Schock oder schwere Verletzungen manifestieren kann. ClO4– blockiert die weitere Hormonsekretion.
Pertechnat ist ein γ-Strahler und wird als radioaktiver Tracer in der Nuklearmedizin verwendet. Da er sich besonders in der Schilddrüse anlagert, ist die intravenöse Gabe von NaTco4-99m gut geeignet um über bildgebende Verfahren (Szintigraphie) deren Aktivität darzustellen.
Stimuliert wird die Jodid-Aufnahme von einem wichtigen Hormon mit dem Namen TSH, welches im Folgenden noch ausführlich behandelt wird.
Bei Autoimmunerkrankungen können körpereigene, autoreaktiven Antikörper die Jodid-Aufnahme und damit die Aktivität der Schilddrüse exzessiv steigern, wie im Falle des Morbus Basedow (engl. Grave’s disease).
Iod wir hauptsächlich in der Form von Iodid über die Nahrung zugeführt. Zufur und Ausscheidung stehen in einem proportional Verhältnis. Die RDA (recommended daily allowance) wird mit 150 μg angegeben.
Befindet sich das Iodid in der Zelle wird es apikal in den Hohlraum, das sogenannte Follikel-Lumen, sezerniert. Dort wird es von einem zentralen Enzym, der Thyreoperoxidase (TPO), oxidiert und damit aktiviert.
Thyreoperoxidase ist ein Häm-(Eisen-)haltiges Enzym.
Letzendlich wird es an eine bestimmte Aminosäure geheftet, dem Tyrosin. Tyrosin ist allerdings nicht frei im Follikel-Lumen vorhanden, sondern liegt gebunden in Proteinen vor.
Das sind die sogenannten Thyreoglobuline, die pro Dimer (zwei zusammengelagerte Proteine) bis zu 140 Tyrosinreste beinhalten. Sie wurden zuvor von den Thyreozyten synthetisiert und in das Follikel-Lumen freigegeben, wo sie nach der Jodisation das sogenannte Kolloid bilden.
Abhängig vom Bedarf wird das Kolloid dann über Endozytose von den Thyrozyten wieder aufgenommen und enzymatisch verdaut. Übrig bleiben die Schilddrüsenhormone, welche dann ins Blut sezerniert werden.
Das Schilddrüsengewebe besteht aus bläschenartigen Follikeln. Diese speichern in ihrem Innern das Kolloid, welches weitestgehend die proteingebundenen Schilddrüsenhormone darstellt. Thyreozyten (=Follikelepithelzellen) nehmen aktiv Iodid über einen Na+/I- Symporter auf und schleusen es in das Innere des Follikels. Gleichzeitig produzieren sie ein gewisses Protein namens Thyreoglobulin (Tg), welches ebenfalls in das Follikellumen sezerniert wird. Das Enzym Thyreoperoxidase (TPO) aktiviert das Iodid und bindet es kovalent an Tyrosinreste des Thyreoglobulins. Zwei dieser jodisierten Thyrosine werden kombiniert um die Schilddrüsenhormone zu bilden. Bei Bedarf wird das Kolloid per Endozytose von den Thyreozyten aufgenommen und verdaut. Dadurch werden die zuvor im Protein gebundenen Schilddrüsenhormone frei und können ins Blut abgegeben werden.
Einer der Schlüsselstellen dieser Kaskade ist die Thyreoperoxidase (TPO).
Um die Hormonproduktion im Falle einer Schilddrüsenüberfunktion zu drosseln kommen in der Therapie sogenannte Thyreostatika zum Einsatz, die die TPO inhibieren (Propylthiouracil, Carbamizol, Thiamazol).
Autoregulation der Schilddrüsenaktivität durch die Jod-Zufuhr
Die Aktivität der Schilddrüse wird durch viele verschiedene Mechanismen reguliert. Einer davon ist das Angebot an Jod, welches relativ unabhängig von den anderen Faktoren die Hormonproduktion bestimmen kann (1 Socolow et al., 1968).
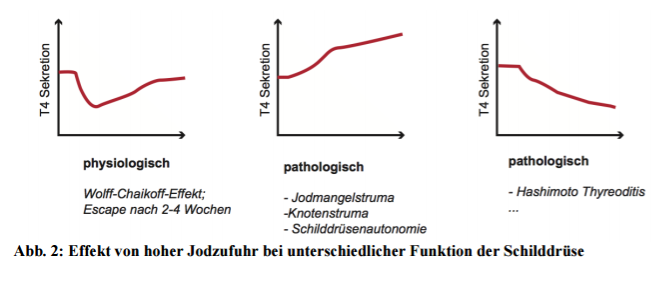
Es ist schon seit den 50er-Jahren bekannt, dass eine drastische Erhöhung der Jodzufuhr die Jodaufnahme und die Hormonproduktion hemmt (2 Wolff and Chaikoff, 1948).
In der Folge wurde dieses Phänonomen nach ihren Entdeckern benannt (Wolff-Chaikoff-Effekt).
Heute weiß man, dass bei einer solchen Jodexposition der oben erwähnte Na/I-Symporter drastisch herabreguliert wird. Eventuell ist dies ein protektiver Mechanismus der Thyreozyten, um den beobachteten oxidativen Stress bei zu hoher Iodzufuhr unter Kontrolle zu halten (3 Eng et al., 1999; 4 Arriagada et al., 2015).
In der gesunden Schilddrüse stellt sich nach der transienten Unterdrückung das sogenannte Escape-Phänomen ein.
Nach 2-3 Wochen stabilisieren sich die Hormonwerte trotz Jodüberschuss.
Je nach Zustand der Schilddrüse kann der Wolff-Chaikoff-Effekt aber sehr unterschiedlich ausfallen. Hier ist wichtig, dass für gewisse Personen eine hohe Jod-Supplementierung etwa über Lugolsche Lösung doch auch Gefahren bergen kann!
Zum Beispiel weisen Menschen mit einem Kropf (Jodmangelstruma) bei einer solch großen Jodgabe kein Abfall der Hormonproduktion auf. Ein Kropf ist in diesem Fall das Resultat von zu wenig Jod. In betroffenen Personen (häufig aus alpinen Regionen) waren bisher alle Mechanismen darauf ausgelegt die Jodaufnahme und Hormonsynthese ans Maximum zu bringen. Verabreicht man diesen Personen dann eine große Jodmenge, resultiert das in einer möglichweise gefährlichen Überfunktion. Eine ähnliche Problematik besteht bei einer Knotenstruma, bei einem autonomem Adenom oder der (stimulierenden) Autoimmunerkrankung Morbus Basedow (engl. Graves disease).
Hier wäre gutgemeinte Iod-Supplementierung eher “Öl im Feuer”. Auch Personen mit der häufigen Autoimmunerkrankung Hashimoto Thyreoditis sollten vorsichtig sein. Hier werden Antikörper gebildet, welche die Schilddrüse angreifen und ihre Funktion einschränken. Das resultiert früher oder später in einer Unterfunktion. Nehmen Betroffene plötzlich große Jodmengen kann sich die Unterfunktion schon früh manifestieren.
Wichtig ist, dass all diese Abnormalitäten den Personen nicht immer bekannt sein müssen. Dann trotzdem auf eigene Faust die Jodzufuhr stark anzuheben, kann zu Problemen führen.
Allgemein ist es sinnvoll, sich im Rahmen von Blutuntersuchungen regelmäßig auch auf Autoantikörper testen zu lassen.
TPO-AK: Antikörper gegen die Thyreoperoxidase (TPO), bei Hashimoto Thyreoditis (und eventuell auch bei Morbus Basedow)
TRAK: Antikörper gegen TSH-Rezeptor bei Morbus Basedow (stimulierend oder inhibierend)
Schilddrüsenhormone – wie sie aussehen, wie sie wirken und in welchen Mengen
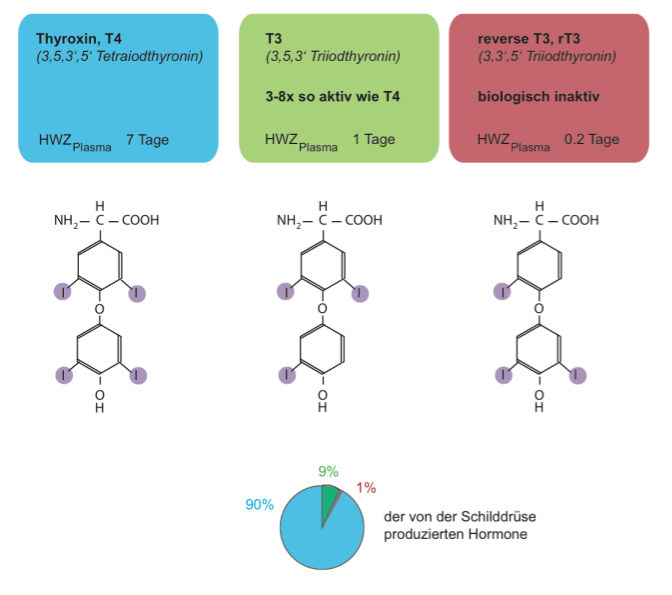
Schilddrüsenhormone bestehen also effektiv aus zwei gekoppelten Aminosäuren – genauer Tyrosine, welche zuvor mit Jod versehen wurden. Für die biologische Wirkung ist es entscheidend, wo und wie viel Jod an die Tyrosine geheftet wurde. Effektiv unterscheidet man zwischen:
Tyroxin (T4) enthält vier Jod-Atome und nimmt mit 90 % mengenmäßig den größten Anteil der produzierten Schilddrüsenhormone ein. Thyroxin wird weitestgehend als Vorstufe für das viel potentere T3 angesehen. Das T3 wird nur in geringerem Ausmaß von der Schilddrüse produziert. 80 % des gesamten T3 wird im Zielgewebe (z. B. der Leber und Muskel) durch enzymatischen Umbau aus T4 generiert. Dieser Prozess heißt Deiodierung und je nachdem welches Jod-Atom entfernt wird kann auch das biologisch inaktive rT3 entstehen. Der periphere Metabolismus der Schilddrüsenhormone und deren Umwandlung in einander wird im Folgenden genauer behandelt. Die Hormone weisen zusätzlich sehr unterschiedliche Halbwertszeiten (HWZ) im Plasma auf. Die “Speicherform” Thyroxin ist deutlich stabiler als die beiden anderen Verbindungen.
Schilddrüsenhormone sind also kleine, recht lipophile Moleküle. Man ging lange davon aus, dass sie auf Grund ihrer Fettlöslichkeit – ähnlich wie Steroidhormone – frei über Membrane diffundieren können.
Allerdings wurden nach und nach zwei Transportsysteme charakterisiert (darunter MCT8/10 und OATP1c1), die den Transport genaustens regulieren (5 Friesema et al., 2003; 6 Schweizer et al., 2014; 7 Mayerl et al., 2014).
Es bestehen Hinweise, dass der Transport in die Zelle durch verschiedenste Faktoren beeinflusst wird, wie zum Beispiel von radikalen Ernährungsansätzen, Übergewicht und Insulinresistenz, Entzündungen oder sogar von der Temperatur und der Tageslänge (8 Hennemann et al., 2007; 9 van der Heyden et al., 1986; 10 Hennemann et al., 1993; 11 Wittmann et al., 2015; 12 Warner et al., 2010).
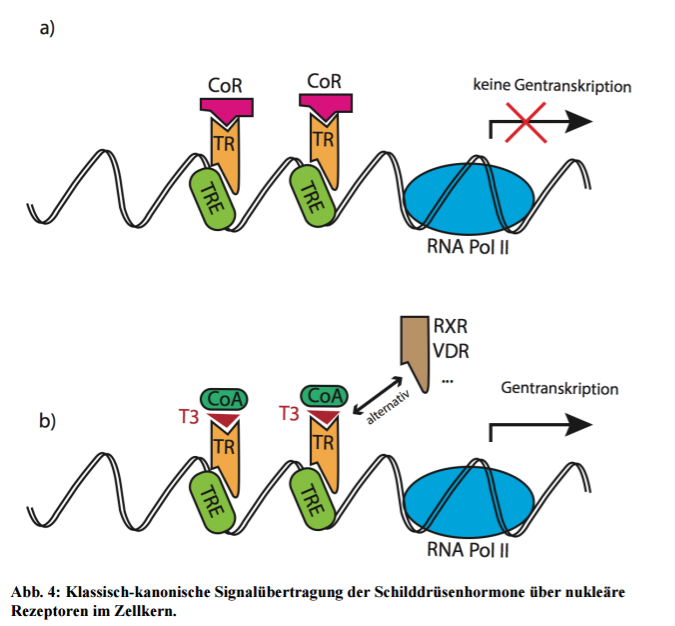
Schilddrüsenhormone binden klassischerweise an sogenannte nukleäre Rezeptoren, die schon im Zellkern im inaktiven Zustand mit der DNA assoziert vorliegen. Sobald T3 an den Schilddrüsenrezeptor gebunden ist, wird das Ablesen von Genen moduliert. Nun wird auch klar, warum es für die Wirkung essentiell ist, dass die Hormone in das Zellinnere gelangen. Blutwerte sind demnach nicht zwangsläufig die sichersten Indikatoren, das alles in bester Ordnung ist. Es zählt, was in der Zelle ankommt.
Die Schilddrüsenhormonrezeptoren (thyroid receptor = TR) lassen sich weiter unterteilen in TR-α1/2 und TR-β1/2. Die einzelnen Subtypen werden in distinkten Geweben expremiert. Dort liegen sie jeweils schon im Zellkern bereit und binden eine gewisse DNA-Sequenz (thyroid receptor-responsive element= TRE). a) Ohne Schilddrüsenhormone sind die Rezeptoren jedoch durch einen Co-Repressor (CoR) inaktiviert. b) T3 kann zusammen mit einem Co-Aktivator (CoA) den Rezeptor aktivieren, der dann entweder alleine oder aber häufiger in einer Zweier-Kombo (Homodimer) wirkt. Noch effektiver werden Gene aber abgelesen, wenn sich zwei unterschiedliche Rezeptoren zusammenlagern (Heterodimer). Mögliche Interaktionspartner der TR-α/β sind zum Beispiel der Vitamin-D-Rezeptor (VDR) oder Retinoid-X-Rezeptor (RXR) (13 Koury et al., 2009). Vor allem die Kombination aus T3 und 9-cis Retinsäure scheint besonders potent im Aktivieren der Gentranskription (14 Kliewer et al., 1992). Bis diese klassische Kaskade Wirkung zeigt, vergeht logischerweise einige Zeit. Bis das Hormon im Zellkern angelangt ist, das Gen abgelesen und in ein Protein übersetzt wurde vergehen in der Regel Stunden. Das oben beschriebene “Lehrbuchwissen” wurde jedoch kürzlich erweitert, indem rapide, non-genomische Wirkungen charakterisert werden konnten. Schilddrüsenhormone müssen demnach nicht unbedingt den langwirigen Weg über die Zellmembran hinein in den Zellkern nehmen, sondern aktivieren zusätzlich auch membranständige Rezeptoren. Ähnlich dem Insulin-Rezeptor benutzen diese dann second-messenger-Systeme, welche zusätzlich den Status der Zelle direkt und unmittelbar beeinflussen können. Die Entdeckung, dass T4 und T3 an das Membran-Integrin avβ3 binden und dadurch PI3K und MAPK Signalwege aktivieren kann, fügte der Schilddrüsenbiologie zusätzliche Komplexität hinzu (15 Moeller et al., 2011)
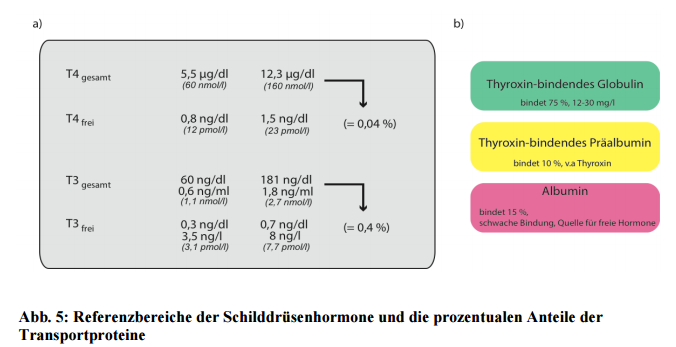
Da Schilddrüsenhormone recht hydrophob (= schlecht wasserlöslich) sind, werden sie nach ihrer Freisetzung ins Blut weitestgehend an Transport- bzw. Bindeproteine gebunden. Proteingebundenen Schilddrüsenhormone fungieren somit quasi als Speicher und nur die sehr kleine Anteile an freien Hormonen vermitteln die eigentliche Wirkung. Nur circa 0,4 % des gesamten T3 und nur 0,04 % des T4 liegt in der freien Form vor.
a) Die jeweiligen Referenzbereiche sind in zwei verschiedenen Maßeinheiten angegeben. Vorgeschlagen u. a. von
der Universität Texas, Southwestern Medical Center, Dallas und dem thyroid disease manager.
b) Die drei relevanten Transportproteine und ihren prozentualen Anteil an der gesamten Hormonbindung.
Was am Ende zählt – Periphere Umwandlung von Schilddrüsenhormonen
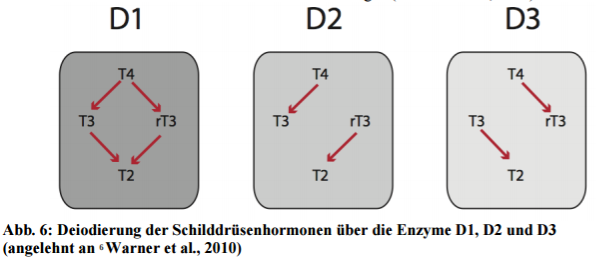
Thyroxin (T4) ist also weitestgehend ein Pro-Hormon des viel aktiveren T3. Es finden sich drei Enzyme, welche Schilddrüsenhormone ineinander umwandeln können. Dies geschieht über das Entfernen von Iodatomen (= Deiodierung).
Deshalb werden sie auch Deiodinasen genannt. Die drei verschiedenen Isoformen unterschieden sich in ihrer Funktion, entfernen entweder ein Jodatom am inneren oder äußeren Phenyl/Thyrosylring und sind in unterschiedlichen Geweben zu finden (16 Bianco et al., 2002).
Mit Hinblick auf die Produktion von T3 wurde lange Zeit die D1 Deiodinase als die wichtigste Isoform angesehen. Sie findet sich vor allem in der Leber, den Nieren und der Skelettmuskulatur.
Sie weist vielerlei katalytische Funktionen auf: D1 kann aus T4 entweder T3 oder rT3 generieren. Das jeweilige Verhältnis dieser Umwandlung (5′- Deiodierung/5-Deiodierung) scheint von verschiedenen Einflüssen abzuhängen:
Bei dem “low T3 syndrom”, wovon wohl viele Insulin-Resistente oder Keto-Jünger/Fastenanhänger betroffen sind (manchmal ein und dasselbe) ist sie zu Gunsten des rT3 verschoben (17 Ruhla et al., 2011). Wichtig ist, dass diese verschobene D1-Enzymaktivität dann nicht nur weniger T3 produziert, sondern auch weniger beim Abbau des entstandenen rT3 mithilft. Das ist nämlich eine weitere Aufgabe, die dann eingeschränkt ist und zur weiteren Akkumulation von rT3 führt.
Selen wirkt als Co-Faktor in dieser Reaktion und ein ausreichender Selenstatus ist für den Schilddrüsenstoffwechsel essentiell!
Wissenschaftler spekulieren inzwischen, dass die zweite Isoform namens D2, im Menschen, eine doch wichtigere Rolle für das gesamte T3 einnimmt.
Der Skelettmuskel ist durch seinen D2-Gehalt für bis zu zwei Drittel des T3 Spiegel im Menschen zuständig (18 Maia et al., 2005). D2 ist auch in verschiedenen Strukturen des zentralen Nervensystems und im braunen Fettgewebe zu finden.
Info von Chris
Braunes Fettgewebe finde ich bei mir spürbar im Nacken. Von allen uns bekannten Faktoren haben Stickstoffmonoxid (NO), Retinsäure (aus Vitamin A) und – wie du im ersten Artikel dieser Reihe erfahren hast – das T3 den größten Einfluss auf die Entwicklung dieser Fettzellen.
Diese Isoform wandelt T4 ausschließlich in T3 um. Auch sie kann zusätzlich rT3 eliminieren. Sie ist in vielen Gehirnbereichen zusammen mit D3 vorhanden. D3 inaktiviert sowohl T4 als auch T3. Die Balance zwischen D2 und D3 in verschiedenen Gehirnbereichen reguliert die lokale Aktivität der Schilddrüsenhormone im Gehirn mit weitreichenden Folgen (19 Lechan et al., 2005).
Info von Chris
Gewusst? Laut Köhrle (et al.) von der Charité in Berlin wird die hepatische Deiodinase-Aktivität massiv negativ beeinflusst durch Eisenmangel, was zur deutlichen Reduktion des zirkulierenden T3 führt. Jod und Selen sind nur ein Aspekt im komplexen Wirkgefüge.
Die Hypothalamus-Hypophysen-Schilddrüsenachse
Die Autoregulation der Schilddrüse durch Jod wurde schon vorgestellt. Neben dieser simplen und direkten Kontrolle nimmt aber vor allem das Gehirn Einfluss auf die Hormonspiegel.
Diese Regulation ist weitaus komplexer und integrativer. Ihr Verständnis ist grundlegend für die Diskussion weiterer Phänomene – inklusive Fasten, die Tageslänge oder wie Entzündungen auf die Schilddrüse wirken.
Im Prinzip beinhaltet dieser Regelkreis drei Komponenten:
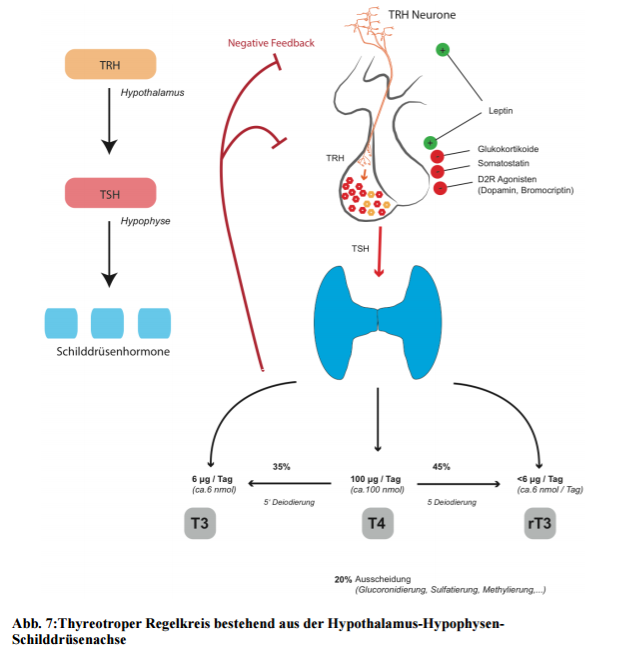
- Nervenzellen im Gehirn (Hypothalamus) produzieren das Neuropeptid TRH
- die Hirnanhangsdrüse (Hypophyse) produziert das Hormon TSH
- die Schilddrüse
Diese Komponenten sind hierarchisch organisiert und das Gehirn fungiert als höchste Instanz.
TRH (thyrotropin-releasing hormone); TSH (thyroid-stimulating hormon aka thyrotropin). Nervenzellen im Gehirn (Hypothalamus) produzieren TRH, welches thyreotrope Zellen in der Hirnanhangsdrüse (Hypophyse) stimuliert. Von dort wird das Hormon TSH in das Blut sezerniert und wirkt in der Folge an der Schilddrüse. Es bewirkt: i) Proliferation und Durchblutung der Schilddrüse ii) Jodaufnahme iii) TPO Aktivität (Jodisation) iiii) Freisetzung der Schilddrüsenhormone. Das primäre Sekretionsprodukt der Schilddrüse ist Thyroxin (T4), von welchem circa 100 μg pro Tag ausgeschüttet werden. In der Peripherie wird T4 enzymatisch zu T3 (ca. 35 %) oder rT3 (ca. 45 %) umgewandelt. Über den Blutweg gelangen die Schilddrüsenhormone ins Gehirn und zur Hirnanhangsdrüse, um durch eine negative Rückkopplung die Leistung der Schilddrüse dem Istwert anzupassen. Steigen die Schilddrüsenhormone im Blut stark an, wird dieser Istwert im Gehirn registriert und TRH und TSH werden reduziert. Gibt es zu wenig Hormone im Blut, stimuliert das die TRH und TSH Produktion und die Schilddrüse wird stärker angetrieben. Deswegen ist der TSH auch der Goldstandard, denn bei einer Unterfunktion geht der Wert durch den Wegfall des negativen feedbacks durch die Decke. Zusätzlich wirken viele Faktoren im Gehirn um den Set-Point der Hypothalamus-Hypophysen-Schilddrüsenachse einzustellen (20 Haugen, 2009).
Eine (stark) negative Energiebilanz reduziert Leptin und niedrige Leptinspiegel vermindern die Produktion von TRH und TSH. Damit wird der Set-Point des Regelkreises abgesenkt – ein protektiver Mechanismus um durch eine verringerte Stoffwechselrate bei wenig Nahrung zu überleben (21 Boelen et al., 2008; 22 Flier et al., 2000). Die geringen Schilddrüsenhormone in der Peripherie würden im gesunden Menschen über Feedback-Signale eigentlich zu mehr TRH und TSH führen – dieser Mechanismus wird aber bei Nahrungsmangel überschrieben. Und wie? Die Konversion von dem wenig vorhandenen T4 in T3 ist im Gehirn lokal erhöht. Die Deiodinase D2 wird im Gehirn bei einem Energiedefizit aufreguliert, wodurch die HPT-Achse unterdrückt wird (mehr dazu im nächsten Teil.)
Mehr Menschen mit subklinischer Unterfunktion als gedacht?
Der riesige Normalbereich von TSH schönt die Statistik. Der Referenzbereich für TSH ist in der Regel mit 0,4 bis 4,0 mU/l angegeben: Das ist eine recht große Spanne!
Es ist eine schon sehr langanhaltende Diskussion, ob die Obergrenze nicht besser auf 2,5 mU/l abgesenkt werden sollte (23 Zechmann, 2007).
Zu hohe TSH Werte deuten auf eine unterdrückte Hormonwirkung hin. Und hier liegt nämlich das Hauptproblem: Würde man die Grenze tatsächlich absenken, würden plötzlich viele als “krank” oder zumindest auffällig eingestuft.
Bei sehr vielen Menschen ist die Schilddrüsenfunktion unterdrückt und das bezeichnet man als subklinische Hypothyreose (TSH auffällig hoch, freien Schilddrüsenhormone im Normbereich). Das Gaspedal ist also komplett durchgetreten, trotz angezogener Handbremse.
Dieser bildliche Vergleich macht klar: so etwas besser vermeiden! Hier noch zusätzlich die biologische Erklärung dazu. Zu hohe TSH-Werte haben neben ihrer stimulierenden Wirkung auf die Schilddrüse auch einige negative Eigenschaften:
- wasserbindende Mukopolysaccharide (verstärktes Wachstum des Bindegewebes)
- teigige Haut, Wassereinlagerungen (Ödeme)
- bei M. Basedow besonders an der Haut über dem Schienbein (prätibiales Myxödem) sowie hervorstehende Augen “Exophthalmus” (retroorbitales Ödem)
- Bei Hashimoto-Patienten häufig erhöhte Permeabilität der Gefäße (interstitielle Ödeme) und ebenfalls Myxödeme
Personen mit einer Unterfunktion wird oft gesagt: “mit Levothyroxin wird alles gut”. Stimmt das?
Aufgrund der oben beschriebenen Konversion von T4 in T3 wird Patienten mit einer Unterfunktion häufig nur L-Thyroxin verschrieben. Allein mir fallen auf die Schnelle drei Frauen in meinem näheren Umfeld ein (2 x Hashimoto, 1 x Schilddrüsenresektion nach Thyreoditis de Quervain), bei welchen durch Autoimmunreaktionen beziehungsweise (virale) Infektion die körpereigene Hormonproduktion unmöglich ist.
Dieser Mangel wird hier und in vielen weiteren Fällen schlicht mit L-Thyroxin substituiert, “es wird doch bedarfsgerecht in T3 umgewandelt”.
Dass diese Annahme bestenfalls optimistisch ist und sicher nicht für jeden gilt, lassen Studien und simples Beobachten der Betroffenen vermuten (24 Bunevicius et al., 1999; 25 McDermott et al., 2012; 26 Wartofsky et al., 2012; 27 Biondi et al., 2012).
Es wird so oft von personalisierter Medizin gesprochen, dem Leitmotiv der kommenden Jahrzehnte. Geld wird fließen … viel Geld. Und doch ist man bei einem der häufigsten Probleme wie der Hypothyreose (6-17 % der Gesamtpopulation) nicht in der Lage, genauer zu hinterfragen woher die Probleme kommen und wie man sie am besten beseitigt.
Die Effektivität der T4-Substitution wurde vor allem in Männern validiert. Frauen sind wohl deutlich benachteiligt, wenn es um den Metabolismus der Schilddrüsenhormone beziehungsweise um die Konversion zu T3 geht. Mit Hinblick auf die höhere Inzidenz von Schilddrüsenerkrankungen bei Frauen ist es recht unverständlich, den vielen weiblichen Betroffenen pauschal diese Medikation nahezulegen. Auch wenn nur ein kleiner Anteil T3 direkt von der Schilddrüse sezerniert wird, hat es eventuell doch eine große Bedeutung für die Balance der Hormone, die Wirkung im Gehirn, dem recht individuellen Eqilibrium zwischen TSH und Schilddrüsenhormone (28 Hoermann et al., 2014; 29 Leow et al., 2014).
All das könnte durch unüberlegte Behandlung gestört werden. Eine reine Thyroxin-Substitution kann zum Beispiel die Konversion und die Ausscheidung von Schilddrüsenhormonen verändern (30 Hoermann et al., 2015; 31 Huang et al., 1997; 32 Huang et al., 1996).
Nicht jeder Patient wird die selbe Gewebsverteilung von Deiodinasen aufweisen. Außerdem wurde festgestellt, dass eine Mutation im Gen für die Deiodinase D2 (SNP Thr92Ala) sehr häufig in hypothyreoten Patienten zu finden ist (25 McDermott et al., 2012). Eine Studie spricht von 16 % aller Untersuchten! Selbsterkärend, dass genau diese Sub-Gruppe durch eine L-Thyroxin Substitution keine großartigen Verbesserungen verspürten. Im Falle einer beeinträchtigten Konversion von T4 zu T3 kann sich nämlich sogar ein Abfall der absoluten Hormonaktivität einstellen (TSH wird ja unterdrückt).
Deswegen wird diskutiert ob eine kombinierte Gabe von T4 und T3 nicht bessere Ergebnisse erzielen würde. Einige Studien präsentieren klare Evidenz, dass sich das Wohlbefinden, psychomotorische und kognitive Leistung und der Stoffwechsel bei einer kombinierten Gabe deutlich verbessern. Es ist natürlich aufgrund der kurzen Halbwertszeit von T3 etwas schwieriger einzustellen. Häufig wird L-T4 von Hausärzten verschrieben, was sich bei der komplexeren Kombinationstherapie zum Teil als schwierig herausstellen könnte.
Das Verhältnis von T4 zu T3 sollte bei 14:1 liegen und eine mehrfache Gabe pro Tag ist empfehlenswert um starke Anstiege zu vermeiden. Selbst bei vielen Studien hakt es hier: Es wird eine fixe Menge an T4 mit T3 substituiert und einmal täglich verabreicht. Zusätzlich wurde in einigen Studien offensichtlich übermedikamentiert, mit der starken TSH-Suppression und zu hohen fT3-Spiegeln als Indiz. Sowohl die Pro- als auch die Kontra-Studien sind also aufmerksam zu analysieren (33 Siegmund et al., 2004).
Eine offen Frage ist auch, ob die Darmflora exogen zugeführte Schilddrüsenhormone metabolisieren und damit inaktivieren kann beziehungsweie in welchem Ausmaß (s. Teil 1).
Die Effekte einer orale Gabe von sowohl T4 als auch einer Kombination von T4+T3 könnte eventuell je nach Darmflora sehr unterschiedlich ausfallen. Gleichzeitig ist bekannt, dass Calcium-haltige Lebensmittel und solche auf Soja-Basis die Resorption von Schilddrüsenhormonen aus dem Darm reduzieren (34 Fruzza et al., 2012; 35 Singh et al., 2001; 36 Zamfirescu et al., 2011).
Es ist also auch rein bezüglich des Magendarmtrakts schwer abzuschätzen, was denn nun im Blut ankommt. Die in den USA recht verbreitete Anwendung von getrockneter Schweineschilddrüse beinhaltet übrigens sowohl T4 als auch T3 und kann auch sublingual eingenommen werden. Dieses natural desiccated thyroid war übrigens die ursprüngliche Behandlung vor der Einführung von L-Thyroxin (einem der meistverkauftesten Medikamenten nebenbei bemerkt … Lobbyismus?).
Abschließende Worte
Durch die vielen Abbildungen ist es hoffentlich doch nicht ganz so trocken gewesen. Mir ist klar, dass edubily-Artikel in der Regel weniger lang sind und mehr Anwendbares liefern. Ich halte es trotzdem für gewinnbringend, die groben Mechanismen und Quantifizierungen auch abgedeckt zu wissen. Und wenn der ein oder andere Betroffene sich über eine Kombinationstherapie T4+T3 informiert und eventuell davon profitiert, bin ich eigentlich schon zufrieden.
Im nächsten Artikel geht’s dann um direkte Vorgaben, was das “low T3 syndrome” ist und was Fasten/Diät mit der Schilddrüse zu tun hat.
Referenzen
1 Socolow EL, Dunlap D, Sobel RA and Ingbar SHA (1968) Correlative Study of the Effect of Iodide Administration in the Rat on Thyroidal Iodide Transport and Organic Iodine Content. Endocrinology.
2 Wolff J and Chaikoff IL (1948) Plasma inorganic iodide as a homeostatic regulator of thyroid function. The Journal of biological chemistry.
3 Eng PH, Cardona GR, Fang SL, Previti M, Alex S, Carrasco N, Chin WW, Braverman LE (1999) Escape from the acute Wolff-Chaikoff effect is associated with a decrease in thyroid sodium/iodide symporter messenger ribonucleic acid and protein. Endocrinology.
4 Arriagada AA, Albornoz E, Cecilia Opazo M, Becerra A, Vidal G, Fardella C, Michea L, Carrasco N, Simon F, Elorza A, Bueno SM, Kalergis AM, Riedel CA (2015) Excess Iodide Induces an Acute Inhibition of the Sodium/Iodide Symporter in thyroid rat cells by Increasing Reactive Oxygen Species. Endocrinology.
5 Friesema EC, Ganguly S, Abdalla A, Manning Fox JE, Halestrap AP, Visser TJ (2003) Identification of monocarboxylate transporter 8 as a specific thyroid hormone transporter. J Biol Chem.
6 Schweizer U, Johannes J2, Bayer D1, Braun D (2014) Structure and function of thyroid hormone plasma membrane transporters. Eur Thyroid.
7 Mayerl S, Müller J, Bauer R, Richert S, Kassmann CM, Darras VM, Buder K, Boelen A, Visser TJ, Heuer H (2014)Transporters MCT8 and OATP1C1 maintain murine brain thyroid hormone homeostasis. J Clin Invest
8 Hennemann G, Krenning EP (2007) The kinetics of thyroid hormone transporters and their role in non-thyroidal illness and starvation. Best Pract Res Clin Endocrinol Metab.
9 van der Heyden JT, Docter R, van Toor H, Wilson JH, Hennemann G, Krenning EP (1986) Effects of caloric deprivation on thyroid hormone tissue uptake and generation of low-T3 syndrome. Am J Physiol.
10 Hennemann G, Vos RA, de Jong M, Krenning EP, Docter R (1993) Decreased peripheral 3,5,3′-triiodothyronine (T3) production from thyroxine (T4): a syndrome of impaired thyroid hormone activation due to transport inhibition of T4- into T3-producing tissues. J Clin Endocrinol Metab.
11 Wittmann G, Szabon J, Mohácsik P, Nouriel SS, Gereben B, Fekete C, Lechan RM (2015) Parallel regulation of thyroid hormone transporters OATP1c1 and MCT8 during and after endotoxemia at the blood-brain barrier of male rodents. Endocrinology.
12 Warner M and Beckett GJ (2010) Mechanisms behind the non-thyroidal illness syndrome: an update. J Endocrinol.
13 Koury EJ, Pawlyk AC, Berrodin TJ, Smolenski CL, Nagpal S, Deecher DC (2009) Characterization of ligands for thyroid receptor subtypes and their interactions with co-regulators. Steroids.
14 Kliewer SA, Umesono K, Mangelsdorf DJ, Evans RM (1992) Retinoid X receptor interacts with nuclear receptors in retinoic acid, thyroid hormone and vitamin D3 signalling. Nature.
15 Moeller LC and M Broecker-Preuss (2013) Transcriptional reguation by nonclassical action of thyroid hormone. Thyroid Research Journal.
16 Bianco AC, Salvatore D, Gereben B, Berry MJ, Larsen PR (2002) Biochemistry, cellular and molecular biology, and physiological roles of the iodothyronine selenodeiodinases. Endocr Rev.
17 Ruhla S, Arafat AM, Weickert MO, Osterhoff M, Isken F, Spranger J, Schöfl C, Pfeiffer AF, Möhlig M (2011) T3/rT3-ratio is associated with insulin resistance independent of TSH. Horm Metab Res.
18 Maia et al., 2005 Maia AL, Kim BW, Huang SA, Harney JW, Larsen PR (2005) Type 2 iodothyronine deiodinase is the major source of plasma T3 in euthyroid humans. HJ Clin Invest.
19 Lechan RM1, Fekete C (2005) Role of thyroid hormone deiodination in the hypothalamus. Thyroid.
20 Haugen BR (2009) Drugs that supress TSH or cause central hypothyroidism. Best Pract Res Clin Endocrinol Metab.
21 Boelen A, Wiersinga WM, Fliers E (2008) Fasting-induced changes in the hypothalamus-pituitary-thyroid axis. Thyroid.
22 Flier JS, Harris M, Hollenberg AN (2000) Leptin, nutrition, and the thyroid: the why, the wherefore, and the wiring. J Clin Invest.
23 Zechmann W (2007) TSH Referenzbereich: Wo beginnt die subklinische Hypothyreose? Endokrinologie&Stoffwechsel.
24 Bunevicius R, Kazanavicius G, Zalinkevicius R, Prange AJ Jr. (1999) Effects of thyroxine as compared with thyroxine plus triiodothyronine in patients with hypothyroidism. N Engl J Med.
25 McDermott MT (2012) Does combination T4 and T3 therapy make sense? Endocr Pract.
26 Wartofsky L (2012) Combination L-T3 and L-T4 therapy for hypothyroidism. Curr Opin Endocrinol Diabetes Obes.
27 Biondi B and Wartofsky L (2012) Combination treatment with T4 and T3: toward personalized replacement therapy in hypothyroidism? J Clin Endocrinol Metab.
28 Hoermann R, Midgley JE, Giacobino A, Eckl WA, Wahl HG, Dietrich JW, Larisch R (2014) Homeostatic equilibria between free thyroid hormones and pituitary thyrotropin are modulated by various influences including age, body mass index and treatment. Clin Endocrinol.
29 Leow MK and Goede SL (2014) The homeostatic set point of the hypothalamus-pituitary-thyroid axis– maximum curvature theory for personalized euthyroid targets.Theor Biol Med Model.
30 Hoermann R, Midgley JE, Larisch R, Dietrich JW (2015) Integration of Peripheral and Glandular Regulation of Triiodothyronine Production by Thyrotropin in Untreated and Thyroxine-Treated Subjects. Horm Metab.
31 Huang WS, Cherng SC, Wang CH, et al. (1997) Increased urinary thyroxine sulfate excretion in thyroxine therapy. Endocr J.
32 Huang WS, Kuo SW, Chen WL, et al. (1996) Increased urinary excretion of sulfated 3,3′,5- triiodothyronine in patients with nodular goiters receiving suppressive thyroxine therapy. Thyroid.
33 Siegmund W, Spieker K, Weike AI, Giessmann T, Modess C, Dabers T, Kirsch G, Sänger E, Engel G, Hamm AO, Nauck M, Meng W (2004) Replacement therapy with levothyroxine plus triiodothyronine (bioavailable molar ratio 14 : 1) is not superior to thyroxine alone to improve well-being and cognitive performance in hypothyroidism. Clin Endocrinol.
34 Fruzza AG, Demeterco-Berggren C, Jones KL (2012) Unawareness of the effects of soy intake on the management of congenital hypothyroidism. Pediatrics.
35 Singh N, Weisler SL, Hershman JM (2001) The acute effect of calcium carbonate on the intestinal absorption of levothyroxine. Thyroid.
36 Zamfirescu I, Carlson HE (2011) Absorption of levothyroxine when coadministered with various calcium formulations. Thyroid.

31 comments On Grundlagen zur Schilddrüse
Hallo, ich habe zugegebenermaßen noch nicht alles im Artikel verstanden und beackert, leider aber seit Jahren sehr unter meiner Hashimoto Erkrankung, trotz toller Endokrinologin an meiner Seite. Richtig abwärts gehts seit dem abstillen nach Geburt meiner Tochter. Mein Gewicht geht derzeit richtig durch die Decke bei unveränderter Ernährung und in Händen einer Ernährungsberaterin die sich leider null mit Krankheitsbildern auskennt. Ich habe in meiner Schwangerschaft kontinuierlich abgenommen und wog nach der Geburt meiner Tochter 14 Kilo weniger als vor der Schwangerschaft. Ich hatte das Gefühl mein Stoffwechsel funktioniere endlich. Ich muss mittlerweile 150 er L Tyroxin einnehmen und nehme trotzdem zu. Meine aktuellen Werte habe ich gar nicht aber zwischenzeitlich war mein Tag bei 70. was kann ich nur tun damit es mir besser geht und ich ins Normalgewicht komme. Ernähre mich sehr gesund. Die Beraterin war quasi ratlos was ich noch anders machen könnte bezüglich der Lebensmittel.
Hallo ihr lieben von edubily,
Hier ist wahrscheinlich nicht wirklich genau der ‚passende‘ Platz für meine Anfrage.
Mir geht es um den weiblichen Hormonhaushalt im Zusammenhang mit Essen bzw. Übergewicht/Leptin/Schilddrüsenfunktion.
Ich lese seit einiger Zeit immer mal wieder ‚querbeet‘ und finde wirklich viele interessante Artikel bzw. auch gut organisierte Empfehlungen zu passenden Artikeln und Studien(hier möchte ich ganz ausdrücklich Eure guten und erneuerten Übersichten loben??).
Da die meisten(glaube ich?) Artikelschreiber männlich sind, habe ich zwar was über Testosteron ( ja, stimmt auch für Frauen interressant und zwar nicht nur bei ihrem Partner ?) gefunden aber nicht wirklich etwas über Zyklusprobleme bzw. -einfluss über den Monat auf unterschiedliche Hormone.
Da sitze ich hier nach meinem (gestillten) Heißhunger auf Süßes und Schokolade und weiß zwar, dass es jeden Monat zur gleichen Zeit diesem Heißhunger gibt, aber nicht ob und wie ich das eventuell mit Hilfe von den entsprechenden Nährstoffen in Lebensmitteln wenigstens reduzieren kann.
Von depressiven Tendenzen und ähnlichem mal ganz abgesehen, auch wenn es schon hilft zu wissen, dass sie mit den Tagen zusammenhängen, sind das zumindest bei mir ziemlich viele Tage, die mich zumindest nur ‚eingeschränkt‘ ‚funktionieren‘ lassen.
Da es oft Frauen sind, die zumindest die Diagnose einer über-oder Unterfunktion der Schilddrüse haben, bzw. eine Unterfunktion durch Schwangerschaft(en) bekommen, denke ich dass hier zumindest die eine oder andere ähnlich interessierte Mitleserin sein wird.
Falls ich trotz meiner Suche einen passenden Artikel zu diesen oder ähnlichen Themen übersehen haben sollte, entschuldigt mich bitte bzw. klärt mich gerne auf, wo ich den finde.
Mit der Befürchtung, dass die Studien zu diesem Thema eher dünn gesät bzw. schwer vergleichbar sind…
Mit freundlichen Grüßen
Petra
Noch eine Nachfrage:
Ihr schreibt oben zu Leptin und SD::
„Eine (stark) negative Energiebilanz reduziert Leptin und niedrige Leptinspiegel vermindern die Produktion von TRH und TSH. Damit wird der Set-Point des Regelkreises abgesenkt … Die geringen Schilddrüsenhormone in der Peripherie würden im gesunden Menschen über Feedback-Signale eigentlich zu mehr TRH und TSH führen – dieser Mechanismus wird aber bei Nahrungsmangel überschrieben. Und wie? Die Konversion von dem wenig vorhandenen T4 in T3 ist im Gehirn lokal erhöht. Die Deiodinase D2 wird im Gehirn bei einem Energiedefizit aufreguliert, wodurch die HPT-Achse unterdrückt wird…“
Mit anderen Worten: Bei einem niedrigen Leptinpegel aufgrund eines zu großen Kaloriendefizits (oder auch bei/nach einem erfolgten erheblichen Fettgewichtsverlust? Wäre auch interessant zu wissen.) wird zwar die T3-Produktion im Körper (außer Gehirn) zurückgefahren (wobei leider nicht klar wird, ob dies nur über eine verringerte T4-Produktion oder dessen Abgabe in der SD geschieht oder auch die SD-externe T4-T3-Konversion in (SD und) den anderen Organen wie Leber und Nieren zurückgefahren wird (geschieht dies auch über TSH?)). Im Gehirn weicht die SD-externe T4-T3-Konversion und damit der T3-Pegel aber davon ab, ist höher.
Heißt das, daß das Gehirn mit einem unveränderten T3-Pegel (wie zuvor) versorgt wird? Was aber jedenfalls auf Dauer betrachtet eine unveränderte T4-Produktion in der SD voraussetzt, denn ein signifikanter Rückgang des T4 muß sich ja bei der SD-externen T4-T3-Konversion entsprechend auswirken.
Wirkt sich dies in Hinblick auf die von SD-Unterfunktionen (oder bei z.B. Hashimoto und reiner T4-Substitution) bekannten Symptome der Lethargie, der abnormen Müdigkeit, des geistigen „Zombie“-Seins, des „Wach-Komas“) aus, also daß diese Symtpome (vorerst) nicht auftreten?
Wenn das so wäre, dann wäre doch die Folge, daß bei zurückgehendem Leptinpegel (und Rückgang der T4-Produktion in der SD) zwar die körperliche Leistungsfähigkeit mit dem (sofern erfolgend) „sofortigen“ Rückgang der SD-externen T4-T3-Konversion im Körper (ohne Gehirn) innerhalb von 15-24 Stunden deutlich nachläßt (kurze Halbwertszeit des bereits produzierten T3 von weniger als 24h), die geistige Leistungsfähigkeit aber bis zum tatsächlichen „Wirksamwerden“ des Rückgangs der T4-Produktion (durch geringeren output der T4-T3-Konversion) erhalten bleibt, was aufgrund der relativ langen Halbwertszeit des T4 (etwa 3 Wochen) 2-3 Wochen dauern würde.
Hinsichtlich einer Diät würde das bedeuten, daß man bereits einige Tage nach dem Absinken des Leptinspegels die Kaloriendifferenz neu berechnen müßte, ggfs. nicht mehr abnehmen, gar zunehmen, würde, was man naturgemäß aber erst mit erheblicher Verzögerung registrieren/messen kann, die durchgreifenden „geistigen“ Symptome, die über die zurückgehende Leptin-Produktion „informieren“, aber erst Wochen später bemerken würde.
Danke für die SD-Artikelreihe. Ich bezweifele, daß ich als Laie alles wirklich verstanden habe, aber dennoch ein paar Fragen:
Der Regelkreis Hypothalamus/Schilddrüse über die T1-T4-Rezeptoren und TSH ist nachvollziehbar und auch an vielen anderen Stellen im Netz erklärt. Auch wenn ich ein paar Worte darüber vermisse, wie diese „eingestellt“ wird, also auf welche Weise der (vermeintlich) „richtige“ Pegel von T1-T4 ermittelt wird.
Aber wie ist das mit der SD-externen T4-T3-Konversion? Die SD-interne Konversion sowie die Erzeugung und T1 und T2 (btw., ein Artikel über T2 wäre sehr erfreulich) hängt ja von Hypothalamus/SD-Regelschleife ab: Wird die Funktion der SD – aus welchem Grund auch immer – zurückgefahren, gibt es aus der SD weniger T1 bis T4.
Hinsichtlich der SD-externen T4-T3-Konversion wirkt sich dies, also die Regelschleife Hypothalamus/SD, doch nur (unmittelbar) durch die Verringerung des zur SD-externen Konversion verfügbaren T4 aus und dann im Ergebnis aufgrund der verhältnismäßig langen Halbwertszeit des T4 nur mit einer vergleichsweisen langen Verzögerung von wenigstens einer Woche und erst nach zwei Wochen kann sich die geringere T4-Produktion der SD auch bei der SD-externen T4-T3-Konversion massiv auswirken.
Daher meine Frage, ob diese SD-externe T4-T3-Konversion auch durch den TSH-Spiegel bzw. irgendwie anders durch den Hypothalamus beeinflußt wird, also auch in einer eigenen Regelschleife läuft oder unmittelbar an die Hypothalamus/SD-Regelung via TSH „angeschlossen“ ist? Oder ist die SD-externe T4-T3-Konversion „nur“ eine sozusagen allein vom T4-Angebot und den anderen Stoffen – welchen (wie Selen, Magensium, Zink etc. ?) – abhängige „lineare“ Konversion?
Interessant ist auch die Frage, welchen Effekt bzw. „Zweck“ die Aufteilung der T4-T3-Konversion auf die angegebenen 9% SD und 80% Leber und Muskel (und wo bleiben die fehlenden 11%?) besitzt. Wer T4 substituieren muß (mangels SD) oder dadurch die SD faktisch lahmlegt, der muß ja ohne diese 9% (oder 20%) T3 und anscheinend gänzlich ohne T2 (und T1) auskommen. Da stellt sich mir die Frage, ob dieser Differenz bei T3 durch eine stärkere SD-externe Konversion ausgeglichen (was die Existenz einer entsprechenden Regelschleife bedingt) wird oder ob es bei dem geringeren Wert an T3 bleibt und es eben Zufall, Schicksal ist, ob man damit zurecht kommt oder ob man zusehen muß, ein T3-Monopräparat via Rezept (oder Kauf in einem BB-Supp-Shop) zu erhalten.
Den Absatz zu den Folgen des Leptinmangels in Bezug auf die SD-externe T4-T3-Konversion – dies ist wohl ab S.3 gemeint – habe ich nicht verstanden. Könntet ihr das noch einmal etwas ausführlicher und auch für Laien verständlich formulieren/erklären?
Die Mechanismen sind wie sind, da kann man nicht sinnvoll über „gut“ und „falsch“ diskutieren.
Aber wenn ich lese, daß das Herunteregeln der SD bei sinkendem Leptinpegel, also Fettverlust, als „ein protektiver Mechanismus um durch eine verringerte Stoffwechselrate bei wenig Nahrung zu überleben“ gilt, frage ich mich schon, wie sich dieses organisches System evolutionär durchsetzen konnte.
Denn die Wirkung des „Herunterfahrens“ der SD erschöpft sich ja nicht daran, daß man einfach nur nicht mehr Höchstleistungen erbringen kann oder schneller friert oder nach Kraftexzessen längere Zeit zur Regenerierung benötigt. Ein derart massiver Rückgang der SD-Hormone führt zu ganz erheblichen Beeinträchtigungen des psychischen Funktionierens – Lethargie, Antriebslosigkeit, Nicht-mehr-Denken-Können („Nebel im Gehirn“, „Watte im Kopf“). Schlimm genug, daß die wie ihr auch anderweitig schreibt seinerzeit üblichen Hungerphasen zwangsläufig auch zu einer akuten Mangelernährung hinsichtlich Vitaminen und Spurenelementen führen, die ja nur teilweise im Körper gebunkert werden, führt, was, wie ihr schreibt, die Hormonproduktion und die Energieerzeugung in den Zellen von sich aus negativ beeinflußt. Wenn auch noch deutlich vor Erreichen eines kritischen Zustands – denn das Fettgewebe dient ja gerade dazu, in Hungerzeiten die Energieversorgung des Körpers zu gewährleisten -, also eines gefährlich niedrigen Fettanteils (der ja erst im einstelligen Bereich gefährlich zu werden beginnt) die SD „heruntergefahren“ und durch die Verringerung der SD-Hormone und besonders T3 der Organismus in einen Zombie-ähnlichen Zustand versetzt wird, ist doch für das aktive Überleben nichts gewonnen.
Klar, in unserer Gesellschaft brauchen wir nur darauf zu warten, daß im übertragenen Sinn der Bernhardiner auftaucht und uns wieder mit Nahrung versorgt. Aber seinerzeit gab es so etwas nicht, da kam nicht der güte Onkel mit einem Freßkorb vorbei, da mußte man schon selbst aktiv werden und Futter beischaffen. Was aber in diesem Zombie-ähnlichen Zustand mit am Boden liegenden T3-Pegel ausgesprochen erschwert, wenn nicht gar unmöglich gemacht wird. Aber vielleicht überschätze ich auch die cerebrale Leistungsfähigkeit und deren Erforderlichkeit bei unserer Vorfahren -immerhin habe sie Hunderdtausende von Jahren gebraucht, um auch nur das Rad zu erfinden. Vielleicht kamen sie auch mit dem Geist eines Zombies durch den Alltag, haben vielleicht überhaupt keinen Unterschied wahrgenommen.
Danke für wen tollen Artikel!
Bei mir ut es genau so der Fall, meine freien feierte t3 und t4 sind hervorragend! Mein tsh wert jedoch deutlich im Unterfunktionsbereich. Ich verstehe leider immer noch nicht ganz wie ich dieses problem beheben kann?
Danke im Voraus!
Hallo, mich wuerde nach den interessanten Infos auch mehr interessieren, xz.b. die Frage von Tobi. Wie geht es nach dem Wolff-chaikoff Effekt weiter? Bleibt die SD auf Hochtouren auch wenn das Jod abgesetzt wird?
Also erst bei Jodgabe blockiert sie sich = unterfkt, dann geht sie in ueberfkt durch escape und danach?
Danke!!
Hallo Chris/ alle,
wie sieht es mit Lugol und Hashimoto aus? Gibt es neue Erkenntnisse oder Kriterien, wann ja, wann nein? Ich versuche mich hier durchzulesen, und es ist alles superspannend, allerdings habe ich wohl zu weit zurueck gepostet.
Vielen Dank fuer evtl Hilfe!!!
Hallo,
Danke für den interessanten Artikel!
Besonders der Teil über den Effekt hoher Jodzufuhr auf die Hormonproduktion! Sowie ich den Artikel verstehe, tritt der Escape Effekt auch dann auf, auch wenn die Jodzufuhr fortgesetzt wird. Gibts dazu ne Quelle oder Referenz?
Bisher hab ich immer nur gelesen, dass sich die Schilddrüsenfunktion 2-3 Wochen nach Ende der Jodgabe normalisiert (z.B. Markou et al. 2001: „thyroid function returns to normal in 2 to 3 weeks after iodide withdrawal“).
Gruß Tobi
Ich Grunde finde ich diese Serie über die Schilddrüse super, aber einen Kritikpunkt habe ich dann doch. Die Warnung vor hohen Jod-Dosierungen in diesem Artikel sind nicht mehr zeitgemäß. Der Wolff-Chaikoff-Effekt, auf den du dich beziehst, wurde längst als großer Irrtum (ja gar als Lüge) in der Medizin entlarvt.
https://www.optimox.com/pics/Iodine/IOD-04/IOD_04.html
Deine Artikelserie ist so umfassend recherchiert, mit solch einer Fülle an Quellenangaben, doch die Studie von Wolff und Chaikoff aus dem Jahre 1948 entspricht nicht dem aktuellen Wissensstand. Da besteht Nachholbedarf.
Für alle Interessierte: das Buch „Die Jod Krise“ von Lynne Farrow ist seit 2015 auf deutsch übersetzt erhältlich. Darin werden verwirrende und falsche Warnungen vor zu viel Jod umfassend entkräftet. Deutschland hinkt beim Wissensstand zum Thema Jod leider deutlich hinterher, vor allem auch wegen der hierzulande weit verbreiteten Angst vor Jod durch Halbwissen aus Büchern wie „Die Jod-Lüge“ von Dagmar Braunschweig-Pauli.
Seit einigen Jahren ist man in den USA innerhalb der Jod-Bewegung dazu übergegangen auch Hashimoto-Patienten mit hohen Jodmengen zu therapieren, mit großem Erfolg und vielen positiven Erfahrungsberichten.
Huhu Mo,
vielen Dank fürs Feedback. Aber das stimmt nicht so ganz. Egal, wie man den Effekt nennt, wir erleben selbst oft, dass Hochdosen zu kurzzeitigem TSH-Anstieg führt.
By the way: Ich wurde hart kritisiert dafür, dass ich in meinem Buch Lugol „empfehle“.
Aber trotzdem: Vielen Dank für die Links, die andere Leser sicher interessiert.
Beste Grüße,
Chris
Danke dir für die schnelle Antwort, Chris.
Ich zitiere mal aus „Die Jodkrise“, S.118:
„Es gibt zahlreiche Berichte über erhöhte TSH-Werte bei Menschen, die Jodergänzungsmittel einnehmen. Das muss nicht zwangsläufig bedeuten, dass Sie sich auf dem Weg zu einer Schilddrüsenunterfunktion befinden. Veränderungen im TSH-Wert können darauf hindeuten, dass sich Ihr Körper verändert, wenn er sich an die Fülle dieses kostbaren Nährstoffes gewöhnt. Im Allgemeinen bleiben die Werte für T3 und T4 im Normalbereich. Erhöhte TSH-Werte sind möglicherweise ein weiteres Beispiel für die „Mangel-Folgeerscheinung“, weil der Körper mehr Gewebe zur Jodabsorption hervorbringt, um das plötzliche überreiche Angebot zu nutzen. Ihr Arzt sollte Dr. Jorge Flechas‘ Artikel „Orthoiodosupplementation in Primary Care Practice“ lesen, der unter http://www.optimox.com/pics/Iodine/IOD-10/IOD_10.htm zu finden ist – besonders den fünften Absatz. Auch Riboflavin und Niacin sind geeignet, den TSH-Wert in den Normalbereich zurückzubringen.“
Und hier noch besagter 5. Absatz von dem Link:
„I request serum T4 (the main hormone produced by the thyroid), free T3 (the biologically active thyroid hormone at the cellular level) and a thyroid stimulating hormone (TSH) level. The T3 level inside the cell correlates very well with the free T3 that is in the serum. Following orthoiodosupplementation, serum T4 and TSH levels usually go down and free T3 stays steady . I have seen TSH sometimes go up rather than down while T4 and free T3 did not change or may have gone up some. This does not mean that the patient was developing hypothyroidism but that the brain was stimulating the body to make more sodium iodide symporters (NIS). The NIS are channels in the cell membrane that transport atoms into a cell as compared to a calcium channel or a sodium channel or a chloride channel where the channel only admits one atom to go through. The NIS transports sodium iodide into cells and has been found in all cell lines tested so far. Thyroid stimulating hormone, prolactin and oxytocin have been found to stimulate the making of NIS. While taking iodide, one may see an elevated TSH but we have to recognize that this is not a bad thing. TSH has many actions outside the thyroid that have been discovered . While taking iodine, the vast majority of patients lose fat and gain muscle weight . Very rarely has weight gain occur. Often a check of the patient’s T4, free T3 and TSH shows the T4 to go down, free T3 going down and TSH going up. Iodide is an essential nutrient that is absorbed by all cell lines. Its highest concentration is seen in the thyroid.“
Der TSH-Anstieg ist, so wie ich das verstehe, darauf zurückzurühren, dass dieses Hormon sozusagen im gesamten Körper die Infrastruktur zur Jodaufnahme in die Zellen aufbaut, in Form dieser Natriumjodid Symporter. Die Schilddrüse wird anscheinend gar nicht mit dem vielen TSH überflutet, da es in all den anderen Bereichen im Körper wirkt.
Was haltet ihr davon?
Beste Grüße,
Mo
Hey Mo,
ich (Chris) bin der letzte, der nicht auch gern über andere Theorien und Hypothesen nachdenkt :-) Insofern: Lesenswert!
In erster Linie auch tolle Infos für die vielen Leser hier. Danke nochmal.
Beste Grüße
Danke dir Chris für den Blog, und Tim für diese tolle Serie. Ich habe viel dazu gelernt und freue mich natürlich wenn ich auch etwas von meinem Wissen teilen kann und wir uns durch den Austausch alle weiter entwickeln können.
In dem Buch werden wie gesagt immer wieder Niacin (als Inositol Hexanicotinat) und Riboflavin als wichtige Begleitnährstoffe genannt, speziell auch das Produkt ATP Cofactors, das im Grunde nur diese beiden Stoffe beinhaltet. Sie senken angeblich den TSH-Wert.
Beste Grüße
Hallo Chris
mir ist nicht ganz klar, welche Therapie bzgl Jod und Hashimoto vorgeschlagen wird. Es gibt extreme Befuerworter und extreme NoGo Positionene. Nichts scheint mir so kontrovers wie dieses Thema.
Ich selbst habe Hashi und nehme nun Jod, Hochdosis, allerdings ist nicht nur der TSH gestiegen, sondern ich habe verstaerkte Entzuendungsreaktionen, so wie ich sie nur bei Ausbruch der Erkrankungen hatte.
Ich suche und suche aber irgendwie finde ich keinen wirklichen Therapieansatz, der irgendwie medizinisch-ethisch und nicht nur kommerziell ist.
Danke!!!
Hallo Mo
gibt es dazu ein Update? Ich habe Hashi, gesichert ;-), bin in Therapie mit T4 und T3 und nun auch Lugol/ Hochdosis Jod.
Ich stosse allerdings immer nur auf wenige positive Hinweise, die gegenteiligen Stimmen sind in der Mehrzahl.
Danke!!!
Danke für den Artikel.
Gibt es denn schon Untersuchungen/Studien wie sich die Sache verhält, wenn man Mg, Se, I + B substituiert? B scheint doch an dem Geschehen einen wesentlichen Anteil zu haben (Nebenschilddrüse, Zirbeldrüse -> F-Reduktion??)
Hi Konrad,
vielen Dank für den Hinweis.
Wir nutzten im alten Blog einen Code im Text, der nun nicht mehr gilt. Wir müssen das entsprechend überarbeiten.
Beste Grüße,
Chris
Danke für den Artikel.
Kurzer Technischer Hinweis an den Blogbetreiber: Der Shortcode content_box box_type=“info“ title=“Info“ ist scheinbar „kaputt“
Ich möchte mich Lob und Freude anschließen, daß wir hier mit solch wertvollen Informationen versorgt werden!
Auch ich werde den Artikel mehrmals lesen müssen, um für mich ein maximales Verständnis herauszuholen.
Als jemand der über 6 Wochen hochdosiert Jod (Lugol) zugeführt hat, mit unerwarteten Ergebnissen, habe ich versucht eine Erklärung für die Entwicklung meiner Werte zu finden. Was mir aber nicht so recht gelungen ist. Welche Erklärungen kann es dafür geben, daß nach einer solchen extremen Jodexposition fT3 spürbar ansteigt, fT4 jedoch konstant bleibt, und der TSH-Wert explodiert?
TSH 1,00 -> 3,44 (0,3 – 2,5)
fT3 2,25 -> 3,01 (2 – 4,4)
fT4 1,03 -> 1,06 (0,9 – 1,7)
Eine Untersuchung beim Facharzt zeigte eine leicht vergrößerte SD (30 ml), jedoch homogenes Gewebe, keine Knoten und keine AK (TPO AK).
Hast du auch Selen zugeführt?
BTW:
TSH ist auch nicht immer TSH.
Die Hirnanhangsdrüse sezerniert ein heterogenes Gemisch an TSH Formen, die sich in den angehängten Zuckerketten unterschieden (Glucose, Mannose, Fructose; deren Verzweigungen; Sulfatierung und Sialylierung).
Das hat Einfluss auf deren Stabilität, biologische Aktivität und Clearance-Rate. Möglich, dass durch hohe Iod-Exposition zb per Feedback diese posttranslationale Modifikation von TSH verändert wird und mehr stabilere, weniger aktive TSH Isoformen produziert wurden, die länger im Blut waren.
Ist aber nur reine Spekulation. Wollte eigtl nicht auf diese TSH Problematik im dritten Teil eingehen, aber vllt jetzt doch in ner Infobox. Muss ich aber noch intensiver recherchieren.
@4ddoc:disqus
Im dritten Teil werden dann auch spezifische Interaktionen von Micronährstoffen, sekundären Pflanzenstoffe und Spurenelementen mit der Schilddrüse angesprochen.
Ja, Selen habe ich mit 400-800 mcg/Tag supplementiert. Wobei mein Selen-Spiegel schon vorher mit 191mcg/l recht gut war. Was Jod angeht, habe ich in den 6w SD-Protokoll nahezu ein ganzes 30 ml Fläschchen 12% LL verbraucht, also 2400mg Jodid / 42 Tage = ~60g / Tag. Möglich daß ich es mit der Dosierung übertrieben und damit meine Schilddrüse überfahren habe???
Diese Woche sind nochmal SD-Werte nach 8 Wochen Jod-Pause genommen worden. Ich möchte das SD-Protokoll jetzt nochmal starten, mit moderater Jod-Zufuhr.
Wäre wirklich toll, mehr über TSH zu erfahren! War jetzt bei drei Ärzten, und es ist klar wenn ich mir nicht selbst helfe tut es sonst keiner (abgesehen vom Hormone verschreiben).
Super Artikel!
Derartige Grundlagen sind natürlich für den gemeinen Patienten nur schwer zu begreifen, aber für alle Interessierten mit grundlegenden Kenntnissen sehr hilfreich.
Generell kommt ein Großteil der Patienten mit L-Thyrox sehr gut klar, aber es gibt bisweilen Fälle wo Thybon wirklich die bessere Wahl ist, aber die behandelnden Ärzte auf diese Idee nicht kommen. Viele kennen es bedauerlicherweise nicht mal. Zudem ist es deutlich teurer als LT und wird von den Kassen nicht ohne weiteres erstattet.
Interessant zum Thema ist vielleicht noch der Einfluss von Grüntee bzw. den Catechinen (EGCG), da viele ja auch Grüntee trinken oder ergänzen:
Die Catechine (und wohl auch andere Flavonoide) können die SD-Funktion negativ herabregulieren. Das kann bei ohnehin grenzwertigem Hormonstatus immer wieder unerklärlich in einen spürbaren Mangel führen (Phasen mit hoher Catechinaufnahme –> fT3 Mangel – Symptome / Phasen mit geringem Konsum –> knapp normale Werte ohne Symptome).
-Mol Cell Biochem. 2013 Feb;374(1-2):37-48. doi: 10.1007/s11010-012-1503-8. Epub 2012 Nov 2.
Catechin induced modulation in the activities of thyroid hormone synthesizing enzymes leading to hypothyroidism.
– Arch Toxicol. 2001 Dec;75(10):591-6.
Goitrogenic effects of green tea extract catechins by dietary administration in rats.
Danke für den Input 4D-Doc – war mir neu!
Bist du eigentlich im Forum unterwegs? Finde deine Beiträge immer sehr gehaltvoll
Hallo Holger!
Vielen Dank, das freut mich! :-)
Bisher noch nicht, das möchte ich aber gerne in der Zukunft einbauen wenn ich es schaffe!
LG!
Danke, Chris, danke! Auch diesen Artikel werde ich meinem Arzt vorlegen, da ich in Kürze einen Arzttermin habe, bei dem ich mir Thybon einfordern möchte (das Medikament mit aktivem T3) Ich denke, er wird große Augen bekommen. Endlich habe ich eine Grundlage, ihm zu erklären, WARUM ich T3 brauche. (Ich habe Hashimoto mit von Antikörpern völlig gekillter SD und fühle mich schlecht nur mit T4).
Super Artikel, sehr schön und verständlich erklärt, besonders auch für Schilddrüsenkranke, die ja so oft nach guten Infos lechzen…! :-)
Hallo Diana,
ich freue mich riesig für dich – genau so soll es sein. Wir wollen, dass Patienten dem Arzt auch ordentliche, gut recherchierte Informationen vorlegen können, so dass er als Folge dessen auch zu einer etwaigen Handlung bereit ist.
Kleine Anmerkung: Das „Danke“ gebührt Tim, nicht mir :-)
Alles Gute dir!
Du hast das Board aufgebaut, eine etablierte Plattform ist genauso wichtig wie die einzelnen Artikel ;)
Freut mich auch riesig, Diana, Danke.
Das war der Ziel des Artikels, in den Diskurs zu kommen und für manche eine bessere Therapie zu erreichen. Evidenzbasiert mit einem Arzt diskutieren zu können hebt alles auf eine andere Ebene. Gerade bei der Schilddrüse beobachtet man leider häufig die EINE „konventionelle“ Behandlung. Für manche ausreichend, für andere nicht. Wenn man die Mutation/den Polymorphismus in der Deiodinase anmerkt und dessen Häufigkeit, wird wohl auch der Arzt bei einem „bad-responder“ die Monotherapie überdenken. Für das etwas kompliziertere Einstellen wird man dann evtll zum Endokrinologen überwiesen, aber was zählt ist eine bessere Verfassung.
Hier sehr gute Primärliteratur (open source):
http://press.endocrine.org/doi/pdf/10.1210/jc.2011-3399
Angenehm geschrieben und geht kritisch auf die „Frustration“ der behandelnden Ärzte ein, wenn bei einigen mit LT4 keine Verbesserung eintritt.
Allgemein hoffe ich, dass die wirklich interessanten Punkte am Ende (TSH-Referenzbereich und Kombinationstherapie) nicht untergehen durch die ausführliche Hinführung^^
Viele, vielen Dank für diese Palltform und für speziell für diese Artikelserie! Mehrmaliges Lesen wird wohl erforderlich sein, um wirkliche alles im Detail zu verstehen.
Nur der Form halber (und weil mir persönlich viel Leid erspart geblieben wäre, wenn alle 3 SD Antikörper untersucht worden wären) – es sollte der dritte SD AK , die thyreoglobulin-Auto- Antikörper (TG-AK), erwähnt werden. Im allgemeinen werden nur die im Artikel genannten AK gemessen, zum Ausschluss einer Autoimmunerkrankung sollten aber alle 3 gemessen werden!
Vielen Dank auch speziell für den oben genannten Link, einige Unsicherheiten bezgl. meiner freien Werte nach gut einem halben Jahr Thybon (nach jahrelanger Monotherapie) , verflüchtigen sich langsam.
Weiter so! Und viele Grüße
Anne
Hallo Taimes
Vielen Dank für Deine Beiträge zur Schilddrüse, die beim Verständnis vieler Vorgänge sehr helfen! Vielleicht hast Du einmal Zeit, Dich mit der Frage der Myxödeme/Lipödeme zu befassen, die einen Grossteil der Hashimoto-Patientinnen zu beklagen haben? Im Schilddrüsenforum von Dr. Brakebusch ist mir dieses Thema schon oft aufgefallen, und auch ich kann keine Hautfalten ziehen, obwohl meine Einstellung (mit Schweinehormonen) sonst gut ist und ich mich wohl fühle. Diese Einlagerungen im Gewebe führen bei vielen Hashimoto-Erkrankten zu einem teigigen und aufgedunsenen Körper und sind sehr unangenehm und natürlich unästhetisch – vielleicht hast Du irgendeine Idee, was man dagegen tun könnte?
LG!
Hallo Dina,
leider fällt mir nichts Gesichertes dazu ein, besonders nicht im Bezug auf Autoimmunerkrankungen. Die Autoimmunantikörper sollte diese Myxödem-Problematik noch weiter verkomplizieren bzw. eine Prognose einer XY-Supplementierung recht schwierig werden lassen.
Bei einer „normalen“ Unterfunktion kann man eben das TSH durch SD-Hormone in den unproblematischen Bereich bringen. Weiters könnte man die verschiedenen Untergruppen von TSH (Isoformen) analysieren, da manche Personen einfach eine ungünstige Mischung an TSH aufweisen. Die weisen dann zB ein schlechte Immunogen zu Bioaktivitätsverhältnis auf.
Ich habe schon einen kurzen, eingeschobenen Artikel fertig geschrieben, der darauf etwas näher eingeht. TSH-Rezeptoren sind ja nicht nur an der Schilddrüse, sondern auch an Lymphozyten und Fibroblasten und manche Personen könnten durchaus mehr TSH-Isoformen (oder auto-AK bei Hashimoto) aufweisen , die vorzugsweise hier wirken und Mukopolysaccharide einlagern.
Wenn ich dennoch auf etwas stoße, was in irgendeiner Form sinnvoll sein könnte, baue ich es in einen Artikel ein.
PS: Die nächsten sollten demnächst schon kommen.
Es wird wohl ein wissenschaftlicher Diskurs zw. mir und Chris….Gerade was Selen angeht, habe ich versucht möglichst objektiv die Datenlage wiederzugeben. Die unterstützt nicht unbedingt Chris‘ (und meine!) Meinung, dass eine ausreichende Selen-Zufuhr in Bezug auf die Schilddrüse seinen Sinn hat.
Chris wird hoffentlich nachvollziehbar ausführen, an welchen Punkten er mit der Datenlage nicht konform geht, und wo er Schwächen in der Interpretation sieht. Wir haben uns darüber kurz ausgetauscht und liegen hier weitestgehend auf einer Wellenlänge (methodische und konzeptuelle Schwächen etc ).
Trotzdem spiele ich den „Miesepeter“, denn Thesen verteidigen, dazu muss man immer in der Lage sein. Ich denke, die Leserschaft wird davon profitieren und das Konzept noch besser umreißen.