Vorwort Chris
Ich bin wirklich froh und dankbar, dass ich euch diesen Artikel und die folgende Serie über die Schilddrüse veröffentlichen darf. Es handelt sich heute um einen Artikel unseres Gastautors Tim, selbst Biologe (Neurobiologe).
Heute gibt es die Gastautoren-Vorstellung direkt zu Beginn:
Tim aka Taimes ist Neurobiologe und interessiert sich besonders dafür, wie das Gehirn sowohl Körpergewicht als auch Blutzucker kontrolliert. Durch seine langbestehendes Faszination für die Glukose-Homöostase und Diabetologie befasst er sich im Speziellen damit, wie das Gehirn dazu beiträgt über Hormone und das autonome Nervensystem den Blutzuckerspiegel im Normbereich zu halten. Etwas atypisch für einen Neurobiologen ist Tim im Amateur-Boxen unterwegs. Seit seiner Jugend trainiert er außerdem leidenschaftlich gerne am Eisen und befasst sich folglich auch praktisch mit Training und Ernährung im Bodybuilding. Seit Herbst 2013 hat er begonnen sich aktiv auf verschiedenen Fitness-Boards zu beteiligen und hat inzwischen großen Gefallen daran gefunden, sich mit anderen Usern auszutauschen.
Dieser Artikel fasst auf sensationelle, aber für einige wohl etwas anspruchsvolle Art und Weise das Thema „Schilddrüse“ zusammen.
Wenn du mein Buch gelesen hast, wirst du den Inhalten problemlos folgen können. Denn das war der Gedanke, die Grundidee, warum wir das Buch geschrieben haben.
Später erschienene Artikel aus der Schilddrüsen-Serie:
- Teil 2: Grundlagen zur Schilddrüse
- Teil 3: Schadest du unbewusst deiner Schilddrüse?
- Teil 4: Wege zur gesunden Schilddrüse
Schilddrüsen-Artikel Nummer eins von Tim
Da immer häufiger von der Schilddrüse die Rede ist, habe ich beschlossen mal ein paar Seiten dazu zu schreiben. Ich möchte es recht umfassend gestalten, damit es auch als eine Art “Nachschlagewerk” geeignet ist. Für den Aufbau habe ich mir Folgendes überlegt:
- Effekte der Schilddrüsenhormone auf den Körper (= “warum-damit-beschäftigen-Appetizer”)
- Anatomie/Feedbacks der Schilddrüsenachse und wie man sie pflegt (Rolle des Gehirns, Leber und des Darms; Mechanismen, Größenordnungen und Tips)
- Circadiane Rhythmik, Fasten und die Schilddrüse (Fasten versus Schilddrüse: Was denn nun tun für die Mitochondrien? Was ist das “euthyroid sick syndrome” und ist es relevant für mich? )
Teil 1: Die Magie um die Schilddrüse
Schilddrüsenhormone spielen eine zentrale Rolle in der allgemeinen Gesundheit, dem Energieverbrauch und der Leistungsfähigkeit. Im Folgenden sind einige bedeutende Effekte der Schilddrüsenhormone gelistet. Deren Einfluss reicht nämlich von der Bioenergetik und oxidativen Kapazität, über die Muskelfaserzusammensetzung bis hin zur Verdauung und der Darmflora.
Starkes “Antioxidanz” bei gleichzeitig „mehr Energie“
Es erscheint anfangs eventuell merkwürdig und man denkt:
Anitoxidanz – das sind doch normal Vitamine oder Dinge aus Pflanzen?!
Nicht ganz: es sind unzählige körpereigene Systeme vorhanden, die den oxidativen Stress regulieren. Dazu zählt nicht nur, dass freie Radikale abgefangen werden (scavanging function), sondern auch, dass diese überhaupt nicht entstehen.
Genau das machen Schilddrüsenhormone indem sie stimulierend auf die Zellatmung wirken.
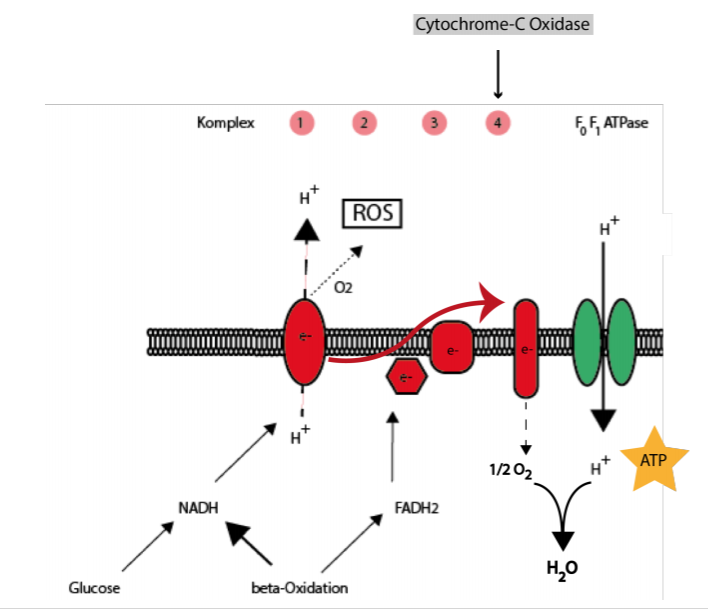
Ein Schlüsselenzym der Atmungskette mit dem Namen Cytochrome-C-Oxidase wird zahlreicher exprimiert und ist aktiver unter dem Einfluss von Schilddrüsenhormonen ([1] Sheehan et al., 2004).
Das sorgt für einen gesteigerten und effizienteren Energiestoffwechsel in den Mitochondrien.
Es werden dementsprechend mehr Substrate bzw. Kalorien umgesetzt und es wird mehr ATP (= Energie) synthetisiert. Außerdem können aufgrund der Stimulation der Cytochrome-C-Oxidase, dem letzten Komplex der Elektronentransportkette, weniger Elektronen “ausbüchsen” um die weitestgehend ungeliebten reaktiven Sauerstoffspezies zu bilden.
Abb. 1: Veranschaulichung der mitochondrialen Atmungskette bestehend aus vier Komplexen und der sogenannten FoF1-ATPase. Bei dem Abbau von Glucose und Fettsäuren entstehen die Reduktionsäquivalente NADH und FADH2, welche Elektronen und Protonen in die Atmungskette der Mitochondrien speisen. Diese Atmungskette besteht aus 4 Komplexen, zwischen welchen Redox-Reaktionen stattfinden (Transfer von Elektronen); zusätzlich werden Protonen (H+) über die Membran gepumpt. Am Ende fließen die Protonen entsprechend ihrem Konzentrationsgradienten zurück und diese proton-motif force wird enzymatisch genutzt um ATP zu synthetisieren. Die zuvor voneinander getrennten Elektronen und Protonen vereinigen sich am Komplex 4 (Cytochrome-C-Oxidase) mit dem antransportierten Sauerstoff zu Wasser. So eine kontrollierte „Knallgas-Reaktion“ ist essentiell, da ansonsten die reaktiven Elektronen entkommen und für oxidativen Stress sorgen indem übermäßig reaktive Sauerstoffspezies (ROS) gebildet werden.
In diesem Zusammenhang von Bedeutung ist, dass Magnesium (Mg2+) das synthetisierte ATP bindet.
Neben vielen anderen lebensnotwendigen Prozessen ist Mg2+ also auch für die Stabilisierung der biochemischen Energie von Nöten.
(Anmerkung Chris: Wir haben schon oft darüber gesprochen, dass Magnesium absolut essentiell ist, um „Energie“ zu spüren – das ist der Grund.)
Personen mit einer Schilddrüsenunterfunktion scheinen zusätzlich zu all ihren Problemen einen eingeschränkten Transport von Mg2+ in die Zelle aufzuweisen ([2] Jones et al., 1966).
Fazit: Mehr Energie in Form von ATP bei einer effektiveren, “Zell-freundlicheren” Entstehung.
Vemehrung der Mitochondrien
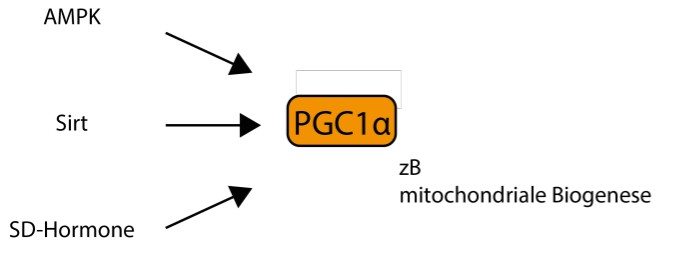
Zusätzlich zu deren Funktion wird auch die Dichte der Mitochondrien in den Zellen beeinflusst. Edubily-Leser werden sich erinnern: Die mitochondrielle Biogenese ist in erster Linie von einem Master-Regulator mit dem Namen PGC1α abhängig. Dieser ist ein integrativer Co-Aktivator und wird nicht nur von Substanzen wie eNOS/cGMP (Stickstoffmonoxid und damit Citrullin), AMPK oder Sirtuinen aktiviert, sondern auch von Schilddrüsenhormonen ([3] Puigserver et al., 1998, [4] Ventura-Clapier et al., 2008).
Neben diesem äußerst potenten Umweg über PGC1α wirken Schilddrüsenhormone aber auch direkt auf das Ablesen einer handvoll mitochondrialer Gene. Dies geschieht wohl über einen verkürzten Schilddrüsenhormonrezeptor-α namens p43 ([5] Wrutniak-Cabello et al., 2001).
Spannend auch die Beobachtung, dass eine Unterfunktion die oxidative Kapazität (= Maß für Energiegewinnung aus Substraten wie Kohlenhydraten, aber vornehmlich Fettsäuren) drastisch reduziert, aber weitestgehend durch einen PGC1α-unabhängigen Mechanismus ([6] Athea et al., 2007).
Es gibt dort also noch einiges zu entdecken!
Fazit: Mehr Mitochondrien und höhere oxidative Kapazität direkt und durch Interaktion mit PGC1α. Letztere wird auch durch Fasten via AMPK und Sirtuinen oder Stickstoffmonoxid (Citrullin) aktiviert (siehe hier, hier und hier).
Abb. 2: Verschiedene Wege der Stimulation des integrativen (!) Co-Aktivator der mitochondrialen Biogenese, PGC1α.
Verstärkte Thermogenese
Es bestehen viele Hinweise, dass SD-Hormone einen großen Einfluss auf die Thermogenese nehmen.
Zusätzliche Wärmebildung geschieht entweder durch unwillkürliche Muskelkontratktionen (shivering) oder durch eine Entkopplung der Atmungskettenphosphorylierung in den Mitochondrien (uncoupling).
Letzteres geschieht ganz besonders im sogenannten braunen Fettgewebe, welches im Erwachsenen im Bereich der Schlüsselbeine und Schulterblätter (supraclavicular bzw. subscapular), der Wirbelsäule (axilär) und den Nieren (perirenal) zu finden ist.
Verglichen mit hibernierenden (= Winterschlaf-praktizierend) Tierarten oder Neugeborenen sind diese Depots beim erwachsenen Menschen weniger stark ausgeprägt. Es finden sich dafür beim Menschen auch einige thermogenetisch-aktive, “beige” Zwischenstufen-Zellen ([7] Jespersen et al., 2013).
Braune und beige Fettzellen speichern im Gegensatz zu weißen Fettzellen nicht einfach nur überschüssige Lipide, sondern können Fettsäuren im Falle von Kälteexposition in Wärme umwandeln. Das versuchen sich Pharmakonzerne wie auch Gesundheitsbewusste zunutze zu machen um überschüssige Pfunde in Form von Wärme verpuffen zu lassen (siehe hier und hier).
Anmerkung Chris
Das ist übrigens auch die Wirkweise vom Algen-Superstoff „Fucoxanthin“ – nur nicht beschränkt auf den Nacken, sondern auf das weiße Fettgewebe am Ganzkörper
Die rot-bräunliche Farbe dieser Fettzellen resultiert aus den vielen Mitochondrien und damit der hohen Dichte an Cytochrom, welches Häm (roten Blutfarbstoff) enthält.
Auch wenn beim Menschen weniger signifikant, lässt sich die Funktionalität dieser braunen und beigen Fettzellen aber durchaus durch regelmäßiges Frieren beeinflussen.
Eine gesunden Schilddrüse ist aber ebenfalls essentiell, reguliert sie doch die Proteine, welche die Thermogenese überhaupt vermitteln ([8] Reitmann et al., 1999; [9] Lanni et al., 2003).
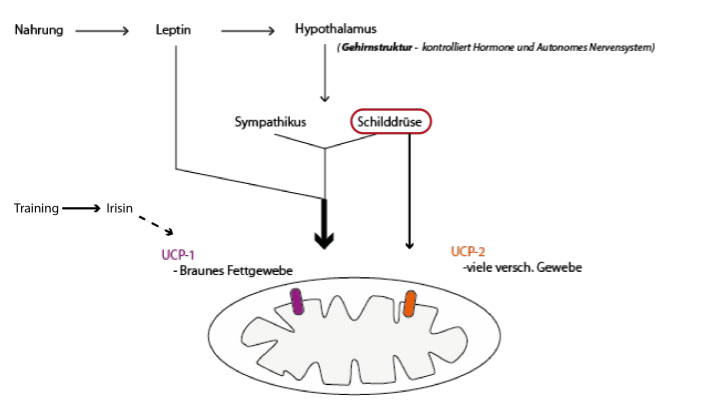
Dies sind die sogennanten “Entkoppler” (uncoupling proteins; UCP’s). In braunem Fettgewebe findet sich die recht gut erforschte Isoform UCP-1. Diese schließt die Atmungskette kurz und bewirkt eine kontrollierte, wärmebildende Reaktion zwischen Protonen und Sauerstoff.
(Anmerkung: Das heißt, dass Energie verpufft, einfach verschwendet wird, um Wärme zu bilden.)
In vielen weiteren Geweben, inklusive Herz-/Skelettmuskulatur und Gehirn, finden sich die weniger gut erforschten Isoformen UCP-2/3.
Auf alle scheinen Schilddrüsenhormone direkt oder indirekt stimulierend zu wirken ([10] Lanni et al., 1997; [11] Queiroz et al., 2004; [12] Coppola et al., 2007; [12] de Lange et al., 2001).
Fazit: Schilddrüsenhormone nehmen Einfluss auf diese UCP’s und erhöhen damit zusätzlich den Energieverbrauch.
Abb. 3: Einflüsse auf die Thermogenese. Verschiedene Systeme nehmen Einfluss auf die Aktivität der “Entkoppler” (UCP-1 und UCP-2). Diese sind in der inneren Membran der Mitochondrien der jeweiligen Gewebe lokalisiert. Das “Sättigungshormon” Leptin kann direkt die Gewebe beeinflussen; Leptin wird aber auch zusätzlich über die Blut-Hirnschranke transportiert und bewirkt dort ausgeprägte Veränderungen in einem Gehirnbereich (Hypothalamus), der das autonome Nervensystem und die Hormonspiegel reguliert. Dies beinhaltet auch die Schilddrüsenachse, welche dort sehr sensibel über den Ernährungsstatus und die Leptinspiegel eingestellt wird (mehr dazu im “Fasten-Teil”). Schilddrüsenhormone wirken zusammen mit dem Sympathikus stimulierend auf die Expression von UCP-1, bilden mehr Mitochondrien im braunen Fettgewebe und steigern dadurch den Energieverbrauch. Außerdem wird diskutiert, ob Training via einem Cytokin namens Irisin zu mehr UCP-1 in Fettzellen führen kann, die dadurch“gebräunt” werden (mehr dazu und hier). Im Gegensatz zu UCP-1 ändern die anderen Entkoppler wie UCP-2 nicht so ausgepägt und flexibel die Protonen-Permeabilität. Sie agieren unabhängig vom Sympathikus, werden aber von Schilddrüsenhormone reguliert. Sie repräsentieren wohl eher basale, konditionelle Entkopplung in vielerlei verschiedenen Geweben. Ihre Abundanz macht ihre Regulation – und damit die Schilddrüse – dennoch zu einer wichtigen Komponente im Energieverbrauch.
Balance von Cholesterin und Steroidhormonen?
Schilddrüsenhormone nehmen Einfluss auf die Bildung von Steroidhormonen und Gallensäure aus Cholesterin. Sollte eine Unterfunktion der Schilddrüse vorliegen, kann diese Tatsache direkt mehrere Probleme implizieren, nämlich zu hohen Cholesterinspiegeln, eine träge Verdauung und eine dysregulierte Bildung an Steroidhormonen.
Tatsächlich stellt man zum Beispiel bei Patienten mit einer Schilddrüsen Unterfunktion regelmäßig Dyslipidämien und eine Hypercholesterolämie fest ([14] van Tienhoven-Wind et al., [15] Rizos et al., 2011; [16] Morris et al., 2001; [17] Luboshitzky et al., 2004).
Gleichzeitig leiden Männer mit einem Mangel an Schilddrüsenhormone häufiger an reduzierten Testosteronspiegeln ([18] Kumar et al., 2007).
Auch bei Frauen finden sich bei Schilddrüsenerkrankungen – übrigens weitaus häufiger bei Frauen als bei Männern ([19] Canaris et al., 2000) – weitreichende endokrine Abnormalitäten (Östrogen/Progesteron Ratio wird diskutiert).
Schilddrüsen-und Steroidhormone sind auf vielerlei Ebenen voneinander abhängig. Es ist wichtig für das Verständnis, dass Entgleisungen in einem System unweigerlich zu Störungen in den jeweils anderen führen.
Allein schon die Effekte im Zielgewebe werden über ähnliche Rezeptorklassen vermittelt, die sich häufig sogar zusammenlagern um gemeinsam z. B. als Dimere präziser und/oder effektiver auf das Ablesen von Genen wirken zu können ([20] Zhang et al., 1996).
Aber nicht nur in der Zielzelle beeinflussen sich diese beiden Hormonklassen sondern auch in ihrer gegenseitigen Synthese.
Im Folgenden will ich am Beispiel des Mannes darauf eingehen, wie Schilddrüsenhormone im Hoden sowohl auf Sertoli- als auch Leydigzellen wirken (jeweils Spermien- und Testosteronproduktion).
Ein adequäter Schilddrüsenstatus ist nämlich für die Fertilität wie auch für die Produktion von Androgenen essentiell ([21] Krassas et al., 2010; [22] Krajewska-Kulak et al., 2013).
Spermien sind sehr anfällig für oxidativen Stress, unter anderem da ihre Membranen große Mengen an mehrfach ungesättigten Fettsäuren enthalten ([23] Tremellen, 2008). Wie weiter oben beschrieben steigern Schilddrüsenhormone grundsätzlich die antioxidative Aktivität und dies wurde auch in den Testikeln festgestellt ([24] Zamoner et al., 2008).
Als Folge erhöht sich wohl letztendlich die Zahl und Motilität der Spermien. Die Schilddrüsenwirkung auf die Spermienproduktion in den Sertolizellen per se werde ich hier nicht weiter behandeln (reviewed in [24] Kumar et al., 2014).
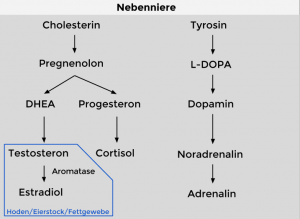
Der Einfluss auf die Steroidogenese geschieht auf mehreren Ebenen und beinhaltet unter anderem die Schilddrüsen-vermittelte Zunahme an Leydigzellen ([26] Ariyaratne et al., 2000).
In den Leydigzellen wirken Schilddrüsenhormone über die Aktivierung des Transkriptionsfaktor SF-1 ([27] Jana et al., 1996), welcher wiederum StAR reguliert ([28] Sugwara et al. 1996).
Das resultiert in einem gesteigerten intrazellulärer Cholesterin-Transport, der Vorstufe für die Androgene.
Abb. 4: Bildung von Steroid-Hormonen – die Grafik kennen wir aus „Handbuch zu Ihrem Körper“, Standardlektüre für Gesundheitsbegeisterte.
Auch das Enzym CYP450scc wird stimuliert und damit die Konversion von Cholesterin zu Pregnenolon ([29] Manna et al., 2001). Allerdings ist bei vielen dieser in vitro Studien auffällig, dass Schilddrüsenhormone bei chronischer Exposition ebenso einige Mechanismen induzieren, welche die Steroidogenese wieder drosseln (z. B. Abnahme an Pregnenolon-metabolisierendem Enzym 3β-HSD).
Trotz allem resultierte die Inkubation von Leydigzellen aus Mäusen und Ratten in einer ausgeprägten Freisetzung an Testosteron ([30] Maran et al., 2000; [31] Manna et al., 1999).
Während dies eher konstitutive Mechanismen sind um Androgen-Vorstufen zu generieren, beeinflussen Schilddrüsenhormone auch die Stimulus-abhängige Produktion. Das Luteinisierende Hormon (LH) aus der Hirnanhangsdrüse ist bekanntermaßen ein grundlegender Stimulus und Schilddrüsenhormone interagieren mit dem Gen des LH-Rezeptors und modulieren letztendlich somit die Dichte und Sensitivität gegenüber des Hormons (29Manna et al., 2001).
Fazit: Blutfette und Cholesterin auf der einen, und Steroidhormone auf der anderen Seite werden durch Schilddrüsenhormone reguliert. Männliche und weibliche Fertilität und Wohlbefinden hängen gleichermaßen davon ab.
Muskelfaserzusammensetzung
Als Sportler weiß man: Die Skelettmuskulatur ist ein äußerst anpassungsfähiges Gewebe und kann sich sicht- und spürbar verändern.
Kontraktion und Hormone sind wichtige Determinanten, die bestimmen wohin die Reise geht. Die Wirkung von anabolen-androgenen Steroiden oder des Wachstumshormons auf die Muskulatur ist im allgemeinen Sportler-Bewusstsein verankert.
Im Vergleich dazu ist weit weniger bekannt, dass auch Schilddrüsenhormone eine sehr profunde Wirkung darauf haben, wie dein Muskel aussieht und was er zu leisten vermag ([32] Salvatore et al., 2014; [33] Lee et al., 2014).
Schilddrüsenhormone modulieren die Expression verschiedener Gene, die essentiell für die Funktionalität und den Stoffwechsel der Muskulatur sind ([34] Simonides et al., 2008).
Dadurch nehmen sie Einfluss auf den metabolischen Phänotyp und das Verhältnis der jeweiligen Fasertypen. Letzteres geschieht über den Einfluss auf die Zusammensetzung des kontraktilen Apparats, genauer den zehn verschiedenen Isoformen der myosin heavy chain MHC-Proteinen.
Letztendlich können die Schilddrüsenhormone also mitbestimmen, wie es um das Verhältnis von oxidativen Typ-1-Fasern zu glykolytischen Typ-2-Fasern bestellt ist (hier zum Nachlesen). Die genaue Regulation ist sehr komplex und das Resultat hängt von vielen Determinanten ab.
Zum Beispiel von den vorhandenen Rezeptoren und Co-Rezeptoren wie dem oben erwähnten P43 ([35] Casas et al., 2008). Generell wird allerdings vermutet, dass eine Unterfunktion der Schilddrüse in einem höheren Anteil und langsameren Typ-1-Fasern resultiert und ein Zuviel an Schilddrüsenhormonen in mehr glykolytischen Typ-2-Fasern ([36] Nwoye et al., 1982; [37] Kim et al., 2013).
(Anmerkung: Wichtig ist, dass Schilddrüsenhormone zwar die kontraktile Eigenschaften (schnell vs. langsam) in Richtung Typ-2-Fasern verschieben, aber gleichzeitig dafür sorgen, dass der Muskel mehr Substrate oxidiert und entsprechend mehr Fett verbrennen kann via Induktion vom oben erwähnten PGC1-alpha. Das haben wir im Buch ausführlich besprochen!)
Das wird vermittelt über den Einfluss auf die Expression verschiedener Gene, deren Produkte für ein weniger lang anhaltenden Ca2+-(Calcium-)Anstieg im Muskel führen. Dies ist charakteristisch für die “schnellen” Fasern, während die “langsamen” Fasern längere Ca2+-Anstiege erfahren. Indem also das Enzym-Set für die cytoplasmatische Ca2+– Entfernung aufreguliert wird, kommt es unweigerlich zu einem Switch hin zu schnellen Fasern.
Schilddrüsenhormone beeinflussen direkt den sarcoplasmatischen Ca2+-Transporter SERCA-1 ([38] Simonides et al., 1996) und die Phosphatase Calcineurin ([34] Simonides et al., 2008), welche wiederum NFAT moduliert.
(Calcineurin-NFAT-Kaskade ist auch gut auf Wikipedia erklärt)
Fazit: Schilddrüsenhormone scheinen die Zusammensetzung der Muskulatur zu verändern und zu mehr Typ-2-Fasern zu führen.
Verdauung
Personen mit Schilddrüsenerkrankungen leiden häufig an Problemen mit der Verdauung. Über-oder Unterfunktionen sorgen gleichermaßen für verschiedene Probleme entlang des Gastrointestinaltrakts ([39] Ebert, 2010). Es kommt häufig zu Übelkeit, Sodbrennen oder Erbrechen, welches in erster Linie mit einer verzögerten Magenentleerungsrate und gestörten Bildung an Magensäure erklärt wird.
Stress-induzierte Magengeschwüre hängen von dem Status der Schilddrüse ab und Schilddrüsenhormone verbessern die Barrierefunktion der Magenschleimhaut ([40] Koyunco et al., 1986).
Aufgrund einer gestörten intestinalen Motilität weisen Personen mit einer Schilddrüsenunterfunktion häufig eine verlängerte Transit-Zeit sowie Verstopfung auf (Du erinnerst dich sicherlich an den Edubily-Post im Facebook?).
Gleichzeitig ist die Bildung und der Fluss an Gallensäure eingeschränkt ([41] Laukkarinen et al., 2002; [42] Laukkarinen et al., 2003; [43] Cakir et al., 2009). Das wiederum scheint nicht nur die Cholesterin-Homöostase durcheinander zu bringen, sondern schränkt ebenso die Fettverdauung und Entgiftung der Leber von allerlei Xenobiotika und (z. B. hormonellen) Abbauprodukten ein.
Häufig ist auch eine Malabsorption an Nährstoffen festzustellen. Personen mit einer Schilddrüsenunterfunktion sind dementsprechend nicht immer zwangsläufig aufgrund des verlangsamten Metabolismus übergewichtig .
Es wirkt aber nicht nur die Schilddrüse auf den Darm, sondern auch der Darm auf die Schilddrüse. Diese reziproke Kommunikation zwischen Schilddrüse und Verdauungstrakt wird in erster Linie von der Darmflora vermittelt.
Wie kurz in einem Nebensatz erwähnt: In der Leber werden verschiedene Xenobiotika und Hormone inaktiviert und ausscheidbar gemacht – darunter auch Schilddrüsenhormone. Nach dem enzymatischen Anhängen verschiedener chemischer Gruppen (Glucoronidierung, Sufatierung, Methylierung,…) gelangen Schilddrüsenhormone über die Galle in den Darm.
Jedoch wird diskutiert, ob dort das inaktive Schilddrüsenhormon in Form eines Sulfat-Konjugats wieder durch bakterielle Enzyme aktiviert und reabsorbiert werden kann ([44] Otten et al., 1982).
Bisher blieb unklar, welche exakte Rolle dieses Recycling von Schilddrüsenhormonen innerhalb des sogenannten enterohepatischen Kreislaufs tatsächlich spielt. Unterschiede bezüglich der Sulfatierung wurden zwischen Menschen und Nagern festgestellt und lassen zusätzliche Zweifel aufkommen ([45] Eelkman Rooda et al., 1989; [46] Kelly, 2000;).
Dennoch ist eine gesunde Darmflora vermutlich grundlegend für den Schilddrüsenhormonhaushalt.
Allgemein bekannt ist auch der Einfluss von erhöhter Endotoxinaufnahme als Folge eines Permeabilitätsstörung des Darms. Gemeinhin als leaky gut bezeichnet treten dadurch vermehrt Lipopolysaccharide (LPS) aus Zellmembranen Gram-negativer Darmbakterien in die Lymphe und das Blut über und verändern den Entzündungsstatus negativ. Auch das kann den peripheren Stoffwechsel der Schilddrüse stören ([47] van der Poll et al., 1999).
Fazit: Der Magen-Darmtrakt (inkl. Darmflora) und die Schilddrüsenachse beeinflussen sich gegenseitig.
Herz
Eine der Gefahren von zu viel Schilddrüsenhormonen ist ihr Effekt auf das Herz. Herzmuskelzellen werden in ihrer kontraktilen Aktivität ähnlich wie die Skelettmuskulatur durch intrazelluläre Anstiege an Ca2+ kontrolliert. Wie weiter oben erwähnt nehmen Schilddrüsenhormone Einfluss auf die intrazelleluläre Ca2+-Dynamik über die Expression des Transporters SERCA-1 ([48] Simonides et al., 2001) und damit auch direkt auf Funktion der Herzmuskelzellen.
Mehrere Rattenstudien und eine Primatenstudie lassen zudem vermuten, dass Schilddrüsenhormone die Dichte der Adrenozeptoren des Herzen erhöhen ([49] Gross et al., 1985; [50] Zwaveling et al., 1996; [51] Zwaveling et al., 1998; [52] Hoit et al., 1997 ).
Diese werden durch Katecholamine wie Adrenalin und Noradrenalin aktiviert und wirken weitestegehend stimulierend (Vargas-Uricoeachea et al., 2014). Durch eine gesteigerte Adrenozeptordichte – so wird spekuliert – vermindert sich die benötigte Menge an Katecholaminen, was letztendlich die Stressachsen in Schach halten soll.
Interessanterweise ist bei einer Schilddrüsenunterfunktion die Stressachse unverhältnismäßig stark aktivier. Nicht selten produzieren diese Personen ein Vielfaches an Adrenalin um unter anderem den Mangel an Schilddrüsenhormone zu kompensieren ([53] Stofffer et al., 1973; [54] Coulombe et al., 1976; [55] Nagel-Hiemke et al., 1981).
Anmerkung:
Radikales Fasten, Diäten und Kohlenhydratrestriktion bewirken gleichermaßen einen Anstieg an Adrenalin und ein Abfall des aktiven Schilddrüsenhormons. In den folgenden Teilen möchte ich darauf eingehen, wie sensibel die Schilddrüse auf jegliche Stressoren reagiert und welche Gefahren die neuen Trend-Ernähungsformen bergen.
Vor allem wenn man sie radikal interpretiert. Hypothyreote Personen produzieren zum Teil das Vielfache an Adrenalin und je nach Funktionalität der Nebennierenrinde auch vermehrt Cortisol. Es ist selbsterklärend, dass diese “Stressreaktion” kein dauerhafter Zustand sein sollte.
Während ein zu viel an Adrenalin ein Problem sein kann, ist auch eine zu hohe Sensitivität gefährlich. Bei Patienten mit einer Schilddrüsenüberfunktion oder bei Medikamentenmissbrauch wirken Schilddrüsenhormone sowohl (i) direkt als auch (ii) indirekt über die Dichte an kardiale Adrenozeptoren negativ auf das Herz ein.
Letztendlich ist eine Schilddrüsenüberfunktion assoziert mit einer gesteigerten Schlagfrequenz (chronotrope Wirkung) und Konraktionsstärke (inotrope Wirkung), einer pathologischen Vergrößerung des linken Herzventrikels, eineschränkter Relaxierung, atrialen Fibrillationen (Vorhhofsflimmern) und letztendlich einer signifikant höheren, kardiovaskulären Mortalität ([56] Duggal et al., 2007).
Während es außer Frage steht, dass Schilddrüsenhormone ausgeprägte Effekte auf das Herz besitzen, bestehen jetzt seit mehr als 50 Jahren Unklarheiten darüber, ob diese Effekte tatsächlich von Katecholaminen vermittelt werden. Die konfuse, heterogene Datenlage ist weitestgehend ein Resultat von uneinheitlichen Studiendesigns, Methoden, outcome measures und so weiter (reviewed in [57] Kim et al., 2004). Für zukünftige, therapeutische Interventionen und die Medikamenten-Entwicklung ist es deshalb von herrausragender Bedeutung, diese Wirkungen im Detail zu verstehen.
Fazit: Neben den Dyslipidämien und der Hypercholesterolämia bergen Schilddrüsen-Abnormalitäten weitere Gefahren für das Herz-Kreislaufsystem in Form von exzessiven Katecholaminspiegel bzw. -sensitivität, aber auch in Form von direkten Effekten.
Abschließende Worte
Obwohl ich ja eigentlich Neurobiologie studiert habe, kam die Wirkung von Schilddrüsenhormone auf das Gehirn (noch) nicht zur Sprache. Kognitive Prozesse scheinen von ihnen moduliert zu werden ([58] Bunevicius et al., 1999) und Dysregulationen korrelieren mit einigen psychologischen Krankheitsbilder wie Schizophrenie und Depressionen ([59] Lasser et al., 1997).
In einem separaten Artikel möchte ich aber ganz besonders die zentrale Regulation der Schilddrüsenachse im Gehirn beleuchten. Zusätzlich will ich in das spannende Konzept der “thermischen” Synapse eintauchen und beschreiben wie Schilddrüsen-vermittelte Wärmebildung im Gehirn die Signalübertragung in klassischen feeding circuits zu modulieren scheint.
Bibliographie
- 1 Sheehan TE, Kumar PA and Hood DA (2004) Tissue-specific regulation of cytochrome c oxidase subunit expression by thyroid hormone. Am J Physiol Endocrinol Metab. http://www.ncbi.nlm.nih.gov/pubmed/14970006
- 2 Jones J, Desper P, Shane SR and Flink EB (1966) Magnesium Metabolism in Hyperthyroidism and Hypothyroidism. J Clin Invest. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC292768/
- 3 Puigserver P, Wu Z, Park CW, Graves R, Wright M and Spiegelman BM (1998) A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis. Cell. http://www.ncbi.nlm.nih.gov/pubmed/9529258
- 4 è Ventura-Clapier R, Garnier A and Veksler V (2008) Transcriptional control of mitochondrial biogenesis: the central role of PGC-1a. Cardiovasc Res. http://www.ncbi.nlm.nih.gov/pubmed/18430751
- 5 Wrutniak-Cabello C, Casas F and Cabello G (2001) Thyroid hormone action in mitochondria. J Mol Endocrinol. http://www.ncbi.nlm.nih.gov/pubmed/11174855
- 6 Athea Y, Garnier A, Fortin D, Bahi L, Veksler V and Ventura-Clapier R (2007) Mitochondrial and energetic cardiac phenotype in hypothyroid rat. Relevance to heart failure. Pflugers Arch. http://www.ncbi.nlm.nih.gov/pubmed/17638011
- 7 Jespersen NZ1, Larsen TJ, Peijs L, Daugaard S, Homøe P, Loft A, de Jong J, Mathur N, Cannon B, Nedergaard J, Pedersen BK, Møller K, Scheele C (2013) A classical brown adipose tissue mRNA signature partly overlaps with brite in the supraclavicular region of adult humans. Cell Metab. http://www.ncbi.nlm.nih.gov/pubmed/23663743
- 8 Reitman ML, He Y, Gong DW (1999) Thyroid hormone and other regulators of uncoupling proteins. Int. J. Obes. Relat. Metab. Disord http://www.ncbi.nlm.nih.gov/pubmed/10454126
- 10 Lanni A, Moreno M, Lombardi A, Goglia F (2003) Thyroid hormone and uncoupling proteins. FEBS Lett. http://www.ncbi.nlm.nih.gov/pubmed/12753895
- 11 Lanni A, De Felice M, Lombardi A, Moreno M, Fleury C, Ricquier D, Goglia F (1997) Induction of UCP2 mRNA by thyroid hormones in rat heart. FEBS http://www.ncbi.nlm.nih.gov/pubmed/9414120
- 11 Queiroz MS, Shao Y and Ismail-Beigi F (2004) Effect of thyroid hormone on uncoupling protein-3 mRNA expression in rat heart and skeletal muscle. Thyroid. http://www.ncbi.nlm.nih.gov/pubmed/15072699
- 12 Coppola A, Liu ZW, Andrews ZB, Paradis E, Roy MC, Friedman JM, Ricquier D, Richard D, Horvath TL, Gao XB, Diano S (2007) A central thermogenic-like mechanism in feeding regulation: an interplay between arcuate nucleus T3 and UCP2. Cell Metab. http://www.ncbi.nlm.nih.gov/pubmed/17189204
- 13 de Lange P, Lanni A, Beneducee L, Moreno M, Lombardi A, Silvestri E and Goglia A (2001) Uncoupling protein-3 is a molecular dertminant for the regulation of resting metabolic rate by thyroid hormone. Endocrinology. http://www.ncbi.nlm.nih.gov/pubmed/11459785
- 14 van Tienhoven-Wind L and Dullaart RP (2015) Low normal thyroid function as a dermtinant of increased large very low density lipoprotein particles. Clin Biochem. http://www.ncbi.nlm.nih.gov/pubmed/25666190
- 15 Rizos CV, Elisaf MS and Liberpoulos EN (2011) Effects of Thyroid Dysfunction on Lipid Profile. Open Cardiovasc Med. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3109527/
- 16 Morris MS, Bostom AG, Jacques PF, Selhub J, Rosenberg IH (2001) Hyperhomocysteinemia and hypercholesterolemia associated with hypothyroidism in the third US National Health and Nutrition Examination Survey. Atherosclerosis. http://www.ncbi.nlm.nih.gov/pubmed/11223442
- 17 Luboshitzky Rand and Herer P (2004) Cardiovascular risk factors in middle-aged women with subclinical hypothyroidism. Neuro Endocrinol Lett. http://www.ncbi.nlm.nih.gov/pubmed/15361814
- 18 Kumar A, Mohanty BP and Rani L (2007) Secretion of testicular steroids and gonadotrophins in hypothyroidism. Andrologia. http://www.ncbi.nlm.nih.gov/pubmed/18076426
- 19 Canaris, GJ,, Manowitz, NR, Mayor, G et al. (2000) The Colorado thyroid disease prevalence study. Archives of Internal Medicine. http://www.ncbi.nlm.nih.gov/pubmed/10695693
- 20 Zhang X, Jeyakumar M and Bagchi MK (1996) Ligand-dependent cross-talk between steroid and thyroid hormone receptors. Evidence for common transcriptional activator(s). J Biol Chem. http://www.ncbi.nlm.nih.gov/pubmed/8662980
- 21 Krassas GE, Poppe K, Glinoer D (2010) Thyroid function and human reproductive health. Endocr Rev. http://www.ncbi.nlm.nih.gov/pubmed/20573783
- 22 Krajewska-Kulak E and Sengupta P (2013) Thyroid function in male infertility. Front Endocrinol. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3826086/
- 23 Tremellen K (2008) Oxidative stress and male infertility-A clinical perspective. Hum Reprod Update. http://www.ncbi.nlm.nih.gov/pubmed/18281241
- 24 Zamoner A, Barreto KP, Filho DW, Sell F, Woehl VM, Guma FC, et al. (2008) Propylthiouracil-induced congenital hypothyroidism upregulates vimentin phosphorylation and depletes antioxidant defences in immature rat testis. J Mol Endocrinol. http://www.ncbi.nlm.nih.gov/pubmed/18316471
- 25 Kumar A, Shekhar S and Dhole B (2014) Thyroid and male reproduction. Indian J Endocrinol Metab. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3826086/
- 26 Ariyaratne HB, Mills N, Mason IJ, Mendis-Handagama SM (2000) Effects of thyroid hormone on Leydig cell regeneration in the adult rat following ethane dimethane sulphonate treatment. Biol Reprod. http://www.ncbi.nlm.nih.gov/pubmed/10993834
- 27 Jana NR, Halder S, Bhattacharya S (1996) Thyroid hormone induces a 52 kDa soluble protein in goat testis Leydig cell which stimulates androgen release. Biochem Biophys Acta. http://www.ncbi.nlm.nih.gov/pubmed/8597565
- 28 Sugawara T, Holt JA, Kiriakidou M, Strauss JF (1996) Steroidogenic factor 1-dependent promoter activity of the human steroidogenic acute regulatory protein (StAR) gene. Biochemistry. http://www.ncbi.nlm.nih.gov/pubmed/8703908
- 29 Manna PR, Kero J, Tena-Sempere M, Pakarinen P, Stocco DM, Huhtaniemi IT (2001) Assessment of mechanisms of thyroid hormone action in mouse Leydig cells: Regulation of the Steroidogenic Acute Regulatory Protein, steroidogenesis and luteinizing hormone receptor function. Endocrinology. http://www.ncbi.nlm.nih.gov/pubmed/11145595
- 30 Maran RR, Arunakaran J, Aruldhas MM (2000) T3 Directly stimulates basal and modulates LH induced testosterone and estradiol production by rat Leydig cells in vitro. Endocrine J. http://www.ncbi.nlm.nih.gov/pubmed/11075722
- 31 Manna PR, Tena-Sempere M, Huhtaniemi IT (1999) Molecular mechanisms of thyroid hormone-stimulated steroidogenesis in mouse leydig tumor cells. J Biol Chem. http://www.ncbi.nlm.nih.gov/pubmed/10026215
- 32 Salvatore D, Simonides WS, Dentice M Zavacki AN and Larsen PR (2014) Thyroid hormones and skeletal muscle — new insights and potential implications. Nat Rev Endocrinol. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4037849/
- 33 Lee J-W, Kim N-H and Milanesi A (2014) Thyroid Hormone Signaling in Muscle Development, Repair and Metabolism. J Endocrinol Diabetes Obes. http://www.jscimedcentral.com/Endocrinology/endocrinology-spid-role-thyroid-hormone-metabolic-homeostasis-1046.pdf
- 34 Simonides WS, van Hardeveld C (2008) Thyroid hormone as a determinant of metabolic and contractile phenotype of skeletal muscle. Thyroid. http://www.ncbi.nlm.nih.gov/pubmed/18279021
- 35 Casas F, Pessemesse L, Grandemange S, Seyer P, Gueguen N, Baris O, Lepourry L, Cabello G, Wrutniak-Cabello C (2008) Overexpression of the mitochondrial T3 receptor p43 induces a shift in skeletal muscle fiber types. PloS One. http://www.ncbi.nlm.nih.gov/pubmed/18575627
- 36 Nwoye L, Mommaerts WF, Simpson DR, Seraydarian K, Marusich M. Evidence for a direct action of thyroid hormone in specifying muscle properties. Am J Physiol. http://www.ncbi.nlm.nih.gov/pubmed/6461259
- 37 Kim TJ, Lee HS, Shin JY, Kim DG, Kim SM, Sung JJ, Lee KW (2013) A case of thyrotoxic myopathy with extreme type 2 fiber predominance. Exp Neurobiol. http://www.ncbi.nlm.nih.gov/pubmed/24167418
- 38 Simonides WS, Brent GA, Thelen MH, van der Linden CG, Larsen PR, van Hardeveld C (1996) Characterization of the promoter of the rat sarcoplasmic endoplasmic reticulum Ca2+-ATPase 1 gene and analysis of thyroid hormone responsiveness. J Biol Chem. http://www.ncbi.nlm.nih.gov/pubmed/8943255
- 39 Ebert EC (2010) The thyroid and the gut. J Clin Gastroenterol. http://www.ncbi.nlm.nih.gov/pubmed/20351569
- 40 Koyuncu A, Aydintu S, Koçak S, Aydin C, Demirer S, Topçu O, Kuterdem E (1986) Effect of thyroid hormones on stress ulcer formation. J Surg Res. http://www.ncbi.nlm.nih.gov/pubmed/3945072
- 41 Laukkarinen J, Koobi P, Kalliovalkama J, Sand J, Mattila J, Turjanmaa V, Porsti I, Nordback I (2002) Bile flow to the duodenum is reduced in hypothyreosis and enhanced in hyperthyreosis. Neurogastroenterol Motil. http://www.ncbi.nlm.nih.gov/pubmed/11975718
- 42 Laukkarinen J, Sand J, Saaristo R, Salmi J, Turjanmaa V, Vehkalahti P, Nordback I (2003) Is bile flow reduced in patients with hypothyroidism? Surgery. http://www.ncbi.nlm.nih.gov/pubmed/12660641
- 43 Cakir M, Kayacetin E, Toy H, Bozkurt S (2009) Gallbladder motor function in patients with different thyroid hormone status. Exp Clin Endocrinol Diabetes. http://www.ncbi.nlm.nih.gov/pubmed/19373757
- 44 Otten MH, de Herder WW, Hazenber MP, van de Boom M and Hennemann G (1982) Iodothyronine sulfatase activity of two anaerobic bacterial strains from rat intestinal microflora. FEMS Microbiology Letter. http://www.sciencedirect.com/science/article/pii/0378109783901374
- 45 Eelkman Rooda SJ, Kaptein E and Visser TJ (1989) Serum triiodothyronine sulfate in man measured by radioimmunoassay. J Clin Endocrinol Metab. http://www.ncbi.nlm.nih.gov/pubmed/2760169
- 46 Kelly GS (2000) Peripheral metabolism of thyroid hormones: a review. Altern Med Rev. http://www.ncbi.nlm.nih.gov/pubmed/10956378
- 47 van der Poll T, Endert E, Coyle SM, Agosti JM, Lowry SF (1999) Neutralization of TNF does not influence endotoxininduced changes in thyroid hormone metabolism in humans. Am J Physiol. http://www.ncbi.nlm.nih.gov/pubmed/9950912
- 48 Simonides WS, Thelen MH, van der Linden CG, Muller A, van Hardeveld C (2001) Mechanism of thyroid-hormone regulated expression of the SERCA genes in skeletal muscle: implications for thermogenesis. Biosci Rep. http://www.ncbi.nlm.nih.gov/pubmed/11725863
- 49 Gross G and Lues I (1985) Thyroid-dependent alterations of myocardial adrenoceptors andadrenoceptor-mediated responses in the rat. Naunyn Schmiedebergs Arch Pharmacol. http://www.ncbi.nlm.nih.gov/pubmed/4033808
- 50 Zwaveling J, Batink HD, de Jong J, Winkler Prins EA, Pfaffendorf M, van Zwieten PA (1996) Thyroid hormone modulates inotropic responses, alpha-adrenoceptor density and catecholamine concentrations in the rat heart. Naunyn Schmiedebergs Arch Pharmacol. http://www.ncbi.nlm.nih.gov/pubmed/8971736
- 51 Zwaveling J, Batink HD, Taguchi K, de Jong J, Michel MC, Pfaffendorf M, van Zwieten A (1998) Thyroid status affects the rat cardiac beta-adrenoceptor system transiently and time-dependently. J Auton Pharmacol. http://www.ncbi.nlm.nih.gov/pubmed/9728320
- 52 Hoit BD, Khoury SF, Shao Y, Gabel M, Liggett SB, Walsh RA (1997) Effects of thyroid hormone on cardiac beta-adrenergic responsiveness in conscious baboons. Circulation. http://www.ncbi.nlm.nih.gov/pubmed/9244231
- 53 Stoffer SS, Jiang NS, Gorman CA, Pikler GM (1973) Plasma catecholamines in hypothyroidism and hyperthyroidism. J Clin Endocrinol Metab. http://www.ncbi.nlm.nih.gov/pubmed/4685392.
- 54 Coulombe P, Dussault JH, Walker P (1976) Plasma catecholamine concentrations in hyperthyroidism and hypothyroidism. Metabolism. http://www.ncbi.nlm.nih.gov/pubmed/958003
- 55 Nagel-Hiemke M, Groß G, Lues I and Schümann H-J (1981) Influence of hypo-and hyperthyroidism on plasma catecholamines in pithed rats. Naunyn-Schmiedeberg’s Archives of Pharmacology. http://www.ncbi.nlm.nih.gov/pubmed/7300918
- 56 Duggal J, Singh S, Barsano CP and Arora R (2007) Cardiovascular risk with subclinical hyperthyroidism and hypothyroidism: pathophysiology and management. J Cardiometab Syndr. http://www.ncbi.nlm.nih.gov/pubmed/17786084
- 57 Kim B, Carvalho-Bianco SD and Larsen PR (2004) Thyroid Hormone and Adrenergic Signaling in the Heart. Scielo. http://www.scielo.br/pdf/abem/v48n1/19531.pdf
- 58 Bunevicius R, Kazanavicius G, Zalinkevicius R, Prange AJ Jr. (1999) Effects of thyroxine as compared with thyroxine plus triiodothyronine in patients with hypothyroidism. N Engl J Med. http://www.ncbi.nlm.nih.gov/pubmed/9971866
- 59 Lasser RA, Baldessarini RJ (1997) Thyroid hormones in depressive disorders: a reappraisal of clinical utility. Harv Rev Psychiatry. http://www.ncbi.nlm.nih.gov/pubmed/9385007

18 comments On Die Schilddrüse – was sie tut und wie sie es tut
Hallo chris wie sollten die schildrüsen werte sein deiner ansicht nach
meine sind tsh 1,5 ft3 5,4 pmol und ft4 20,6 pmol
Ein sehr interessanter Artikel! Ich habe die Vermutung, dass ich eine Schilddrüsenunterfunktion habe. Das kommt bei mir in der Familie recht häufig vor. Jetzt weis ich auf jeden Fall schonmal genauer, wofür die Schilddrüse wichtig ist und werde mich untersuchen lassen. Viele Grüße
Im nächsten Artikel wird es noch deutlich mehr „Vorlegbares“ geben :)
Habe versucht einige Denkanstösse zu Papier zu bringen.
– Referenzbereich von TSH hinterfragt (lange schon in der Diskussion)
– Kombinationstherapie mit T4/T3 auf Grund individuellen Vorraussetzung (ca 20% können auf Grund ihrer Genetik mit einer Levothyroxin-Monotherapie überhaupt nicht gut fahren!!!!!)
-…
Denke mal, der Artikel wird bald kommen
Grüße
Allerherzlichsten Dank für diesen Artikel! Endlich etwas, was ich den
Ärzten vorlegen kann, denn alle oben geschilderten Tatsachen und Zusammenhänge sind diesen
zum größten Teil unbekannt. Macht man sie dann auf o.g. Beschwerden
aufmerksam und bittet um Abhilfe, „bildet man sich das alles nur ein“,
das kann doch nicht an der SD liegen, da man ja doch SD-Hormone
substituiert…. Schade, dass Euer Fachgebiet nicht im Medizinstudium
gelehrt wird, es wäre bitter nötig…
LG Diana
Hey Diana,
vielen Dank für deine Worte! Wir freuen uns sehr, wenn wir helfen können. :-)
Berichte doch, was der Arzt zu diesem Artikel gesagt hat.
LG, Chris
Hi Chris,
der Arzt war überraschenderweise sehr interessiert und hat mir dann Thybon (T3) verschrieben. Ich habe es nun seit einer Weile genommen und bin mental und kognitiv viel fitter..aber: ich habe 6 kg zugenommen in 4 Wochen! Trotz 3x die Woche Kettlebell-Training und Ernährung nach deinen Empfehlungen plus Arginin, L-Carnitin, Zink, Rinderleber usw. usw.
Ich habe nun herausgefunden, dass T3-Einnahme Insulinresistenz verursacht. Ich bin völlig ratlos, mutlos und verzweifelt. Ich melde mich besser mal im Forum.
LG Diana
Hey Diana,
Insulinresistenz eigentlich nur bei zu viel T3. Und selbst wenn: Dann iss doch mehr Fett und weniger Kohlenhydrate :-)
Aber: Mal darüber nachgedacht, dass es sich dabei um Magermasse handelt?
T3 reguliert die Protein-Synthese usw.
LG, Chris
Magermasse..hmm..schön wär’s… sieht aber absolut nicht nach Magermasse aus.. ;-)) Ich denke, ich habe wohl T3 zu hoch dosiert und mich in eine Insulinresistenz geschossen. Hab auch gleich vor lauter Schreck auf LCHF- Ernährung umgestellt,denn es wurde auch noch eine Glutenunverträglichkeit bei mir festgestellt..
Aber trotzdem machen mir Eure tollen und interessanten Artikel immer Mut und ich bleibe dran, befolge alle Eure Ratschläge, denn ich merke, es geht mir besser damit. Ich bin Euch wirklich sehr dankbar dafür.
LG Diana
Hallo,
Wo finde ich denn jetzt die Menge für die Edukte zur T 3 Bildung, im Buch steht das ja leidet nicht.
Einige der Ernährungstechniken aus dem Buch betreibe ich seit Jahren und ich muss sagen,Leistungssteigerung ist auf diese Weise möglich. Jetzt habe ich noch mehr zum Ausprobieren
Hallo Ralf,
zum Beispiel im Forum.
Herzliche Grüße,
Chris
Kann es sein, dass die Kommentarfunktion nicht tut, was sie sollte? Ich finde es auch ein wenig schade, dass man zum Kommentieren zwangsläufig einen Login benötigt. Warum?
Zum Artikel: ich würde mir wünschen, dass genauer spezifiziert wird, welche Schilddrüsenhormone etwas beeinflussen. Für mich macht es einen großen Unterschied, ob in einer Studie das TSH, fT3, fT4 oder andere SD-Hormone in ihren Wechselwirkungen betrachtet werden.
Hallo Tina,
die Kommentarfunktion ist in Ordnung – was läuft denn nicht richtig?
Wer posten will, der wird das auch tun, trotz der Tatsache, dass er sich eine Minute Zeit nehmen muss, um sich einen Login zu basteln.
Da TSH und T4 keine wesentlichen Einflüsse auf zelluläre Parameter nehmen, sprechen wir natürlich immer von T3, genauer: freies T3.
Herzliche Grüße,
Chris
Hallo Chris,
das vermeintliche Nichtfunktionieren der Kommentarfunktion war meinem Unvermögen geschuldet. ;-) Ich sehe es trotzdem kritisch, dass man zum Erstellen eines Accounts (egal wo) gezwungen wird, nicht aus zeitlichen, sondern eher aus Privatsphäregründen. Aber egal.
D.h. all die angeführten Studien haben tatsächlich fT3 als Parameter genutzt? Ich habe jetzt noch nicht reingelesen, aber das wäre ja phänomenal. Mir ist eben auch klar, dass dieses der wichtigste Wert ist, doch oft genug betrachten Studien (und Ärzte) diesen halt gerade nicht.
Ehrlich gesagt kann ich kaum glauben, dass ein nenneswerter Anteil obiger Publikationen wirklich Bezüge zwischen dem fT3 und zelllulären Vorgängen herstellt.
Es ist meiner Meinung nach von ganz entscheidender Wichtigkeit, wie man Hypo- bzw. Hyperthyreose exakt definiert.
Selbst habe ich z.b. zurzeit einen fT3 unter der Norm, bei einem TSH von 0,12 und akzeptablem fT4. Ganz klar hypothyreod, aber für 90% der Ärzte eine Überfunktion….
Vielen Dank für die informativen Artikel!
Tina
Hey Tina,
okay, dann bin ich beruhigt. Ja, das ist zwar wahr, allerdings ist genau das ein Grund, wieso wir eine Anmeldung fordern.
Wenn der Mensch nicht 100 % anonym posten kann, dann wird er auch nicht zum Internet-Rambo, der sich mit „fachkundigen Kommentaren“ profiliert. Darüberhinaus verhindert es Spam. Es dient also der Selektion – wir hätten gerne auch hier in den Kommentaren Netiquette.
Na ja, wie gesagt: Aktive Effekte von Schilddrüsenhormonen ergeben sich zu > 80 % über T3.
Gut … deine Schilddrüsen-Werte lassen vermuten, dass du Medikamente nimmst?!
Herzliche Grüße,
Chris
Hallo Chris,
ja, ich nehme Medikamente (Hashimoto, seinerzeit diagnostiziert bei einem TSH von 52 und fT3/fT4 unter der Norm). Obige Blutwerte entstanden unter 125 µg T4 und 10 µg T3.
Habe daraufhin nun auf 125/20 erhöht.
@Diana: ja, ich weiß, wie das für einen Arzt aussieht, weiß aber auch, was es für mich bedeutet. ;-)
Es „ärgert“ mich halt nur, dass man als Patient damit idR vollkommen allein gelassen wird. Jedenfalls habe ich in den letzten Jahren keine kompetente Unterstützung gefunden. Aber immerhin habe ich einen Hausarzt, der mir L-Thyroxin und Thybon verschreibt und regelmäßig Werte macht.
@Chris: du schreibst: „Na ja, wie gesagt: Aktive Effekte von Schilddrüsenhormonen ergeben sich zu > 80 % über T3.“
Genau, so ist es. Man darf daher aber auch nicht den Fehler machen, dass man Studien, die das fT3 gar nicht gemessen haben, so interpretiert, als würde zu diesem Parameter tatsächlich ein direkter (gemessener) Bezug hergestelllt worden sein.
Ich meine das wirklich nur als konstruktive Kritik und bin mir durchaus bewusst, dass ihr im Artikel in erster Linie von Effekten des fT3 sprecht, doch steht es da einfach nirgendwo explizit. ;-)
Herzliche Grüße
Tina
Hi Tina, für die Ärzte hast du eine ÜF wegen deines niedrigen TSH…die meisten können die Werte von fT3 und fT4 nicht richtig deuten. Für mich sieht das bei dir eher wie eine Konversionsstörung aus, d.h. die Umwandlung von fT4 in fT3 klappt nicht richtig…
LG Diana
Hallo,
ich habe total vergessen hier reinzuschauen.
Im zweiten Artikel, welchen Chris wohl bald öffentlich stellen wird, wird sehr genau differenziert zwischen en Hormonen.
Es wird einige, sehr praxisbezogene Denkanstösse geben, die man dann durchaus mit dem Arzt diskutieren kann. Wirkliche Tipps kommen im dritten Teil.
Grüße
Tim
Prima, bitte mehr davon! Gerade für mich als Hashimoto-Betroffene höchst interessant.