Ein sehr guter Modell-Organismus zum Studieren von eukaryotischer Molekular- und Zellbiologie ist die Backhefe. Ein einzelliger Pilz. Diese Zellen nutzt man, um Erkenntnisse für unsere eigenen Zellen zu gewinnen.
Hefezellen: Entweder glykolytisch oder oxidativ
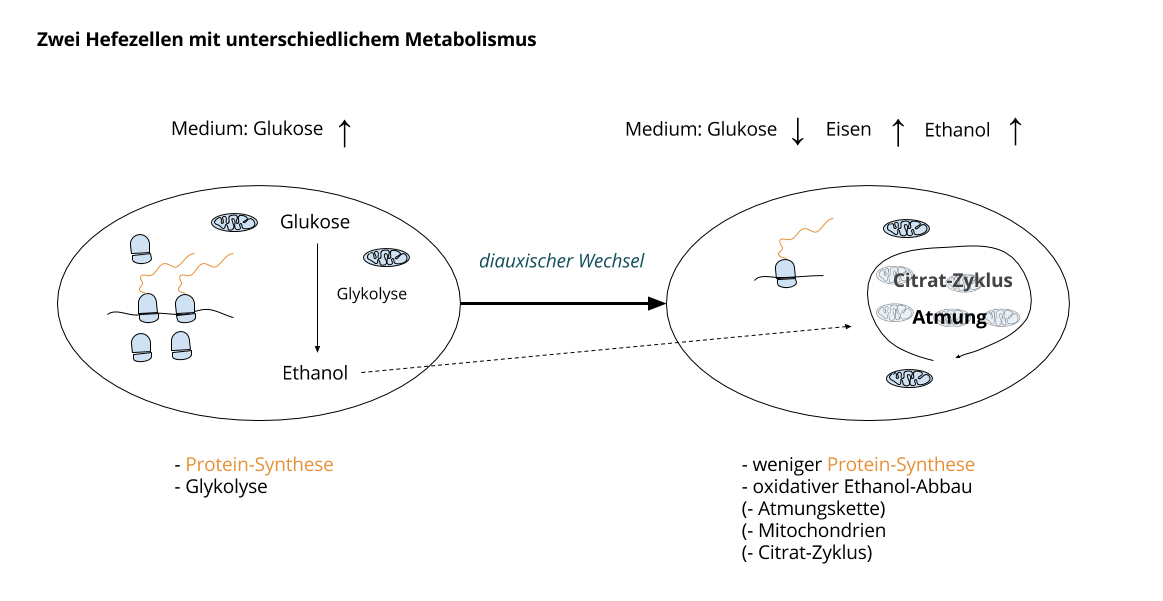
Hefezellen können grundsätzlich zwei verschiedene Systeme zur Energiegewinnung nutzen. Einmal fermentativ, das heißt hauptsächlich Glykolyse mit bevorzugtem Substrat Glukose, einmal oxidativ, das heißt der vollständige Abbau des Substrats, in diesem Falle dann Ethanol.
Der Pilz fermentiert in der ersten Phase Glukose. Das Abbauprodukt ist Ethanol. Dieser reichert sich in der Umgebung an. In der zweiten Phase baut der Organismus dann Ethanol vollständig oxidativ ab.
Der Wechsel zwischen den beiden Phasen nennt man diauxischer Wechsel.
Bei diesem Wechsel passiert etwas Spannendes:
- Es werden deutlich weniger Proteine gebildet, die beim Zuckerabbau (Glykolyse) und bei der Protein-Synthese beteiligt sind.
- Gleichzeitig werden mehr Proteine gebildet, die für die Gluconeogenese, den Citrat-Zyklus und die Atmungskette (Elektronentransportkette) zuständig sind. Es werden außerdem massiv mehr Mitochondrien gebildet.
Zwei ganz wesentliche Rollen spielen dabei einmal die Glukose-Verfügbarkeit und einmal die Eisen-Verfügbarkeit.
Die Zelle switcht von Glykolyse und Protein-Synthese zu oxidativer Stoffwechsel und weniger Protein-Synthese, wenn weniger Glukose vorhanden ist. Umgekehrt kann dieser Wechsel nur passieren, wenn die Eisen-Mobilisation klappt. Dafür hat die Hefe Speicher in der Zelle, kann aber auch Eisen aus der Umgebung aufnehmen.
Ganz ähnlich auch bei uns Menschen
Das Lustige an der Sache ist, dass wir diesen „Wechsel“ kennen. Von unserem eigenen Muskel. (Freilich wird dort nicht Ethanol, sondern Fettsäuren abgebaut.)
Das sah, im Handbuch niedergeschrieben, in etwa so aus:
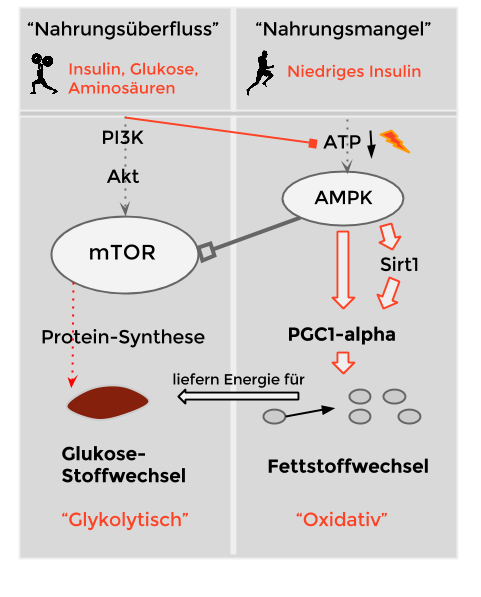
Auch wenn das ein wenig komplex(er) aussieht, am Ende (ganz unten) steht das Gleiche: Entweder glykolytisch und Protein-Synthese oder oxidativer Stoffwechsel und Mitochondrien.
Auch hier galt: Die Glukose-Verfügbarkeit reguliert unter anderem den muskulären Stoffwechsel.
(Anmerkung: Immer daran denken, dass wir uns entlang eines Spektrums bewegen und nicht von heute auf morgen von glykolytisch auf oxidativ (oder umgekehrt) switchen können und das Ganze beim Menschen komplexer ist als in einer einzelnen Zelle!)
Eisen – Gut für die Fettverbrennung, schlecht für die Glukose-Toleranz
Gerade liegt eine Arbeit vor mir, die ganz klar aufzeigt, wie Eisen das Diabetes-Risiko verändert. Klare Botschaft: Mit Eisen-Restriktion kann man den Glukose-Stoffwechsel ganz dramatisch verbessern und die Bauchspeicheldrüse komplett schützen – so, dass selbst bei Nagetieren, die quasi-misshandelt werden (Mast), die Bauchspeicheldrüse perfekt funktioniert und der Glukose-Stoffwechsel nicht entgleist.
Die Autoren betreiben Ursachen-Forschung und legen folgende Gedanken dar:
- Eisen moduliert den Stoffwechsel ganz weitreichend. Weitreichender als nur im Hinblick auf die Insulin-Sekretion
- Eisen beeinflusst die Insulin-Sensitivität durch einen komplexen Mechanismus, der die AMPK-mediierte Glukose-Aufnahme, das Glukose-Cycling der Leber und die Adipokin-Produktion betrifft
- Speziell: Eisen verstärkt die Fettsäure-Oxidation, so, dass Mäuse, denen man viel Eisen verfüttert, „hypermetabolisch“ werden, wenn man sie mästet – das passiert nicht bei der normalen Ernährung
- Das führt dazu, dass Eisen-Mäuse recht gut geschützt sind gegenüber Fettleibigkeit und fettleibigkeitsinduzierter Insulin-Resistenz
- Eisen verstärkt die Fettsäure-Oxidation zugunsten der Glukose-Oxidation
- Eisen hat allerdings „zwei Seiten“: In allen Modellen schützt Eisen-Restriktion die ß-Zell-Funktion (Insulin-produzierende Bauchspeicheldrüsen-Zellen) und wahrt die Insulin-Sensitivität
- Aber: Eisen moduliert den Fettstoffwechsel und somit Fettleibigkeit und den Stoffwechsel, allerdings kommt es darauf an, welche Ernährungsform man wählt
Die Autoren übersetzen das für uns. Ein niedriger Ferritin-Wert ohne Eisen-Mangel heißt: sehr gute Glukose-Toleranz (aber eine schlechtere Fettverbrennung). Umgekehrt sagen die Autoren, dass „mehr Eisen“ zu einer gesteigerten Fettsäure-Oxidation führt.
Ähnliches wurde von uns bereits postuliert
Im Trainingsguide hatte ich damals ähnliche Einblicke gegeben:
Box 12: Eisen – zweischneidiger geht nicht
Die Eisenverfügbarkeit reguliert die Sauerstoffverfügbarkeit des Muskels. Und noch viel wichtiger: Es reguliert die so genannte Sauerstoffbindekapazität des Muskels, denn die wird reguliert durch ein eisenhaltiges Enzym, das in der mitochondrialen Atmungskette lokalisiert ist.
Das Thema Sauerstoffbindekapazität ist ganz neu: Zum ersten Mal scheint klar zu sein, wo muskuläre Ausdauerleistungsfähigkeit steigt und fällt und vor allem … wo der Kalorienumsatz entsteht (Schiffer, 2010). Der Kalorienumsatz entsteht anscheinend genau dort: Je höher der Sauerstoffumsatz (= höhere Sauerstoffbindekapazität und höhere oxidative Kapazität), umso höher auch der Kalorienverbrauch.
Dies erklärt ein Naturparadox: Die besten Ausdauerathleten im Tierreich haben die höchsten Kalorienausgaben, obwohl man genau das Gegenteil annehmen würde. Denn es ist ökonomisch einfach nicht sinnvoll, ein Ausdauerathlet zu sein und gleichzeitig energetisch ineffizient. Aber anscheinend schließen sich Effizienz (auf Stoffwechselebene im Muskel) und Leistungsfähigkeit aus.
Fakt ist: Nie hatte ich dauerhaft einen niedrigeren RQ (Maß für die Oxidation von Fettsäuren) als zu Zeiten, wo Eisen (gemessen anhand des Ferritins) am höchsten war.
(Anmerkung: Dies könnte man auch schlicht damit erklären, dass ich im Verhältnis weniger Kohlenhydrate oxidiert habe – siehe unten -, dann nämlich verschiebt sich auch der RQ.)
Doch dieses extreme Verschieben in Richtung oxidativer Stoffwechsel (= Fettverbrennung) bringt auch Nachteile mit sich: Die Glukose-Utilisation ist herabgesetzt und somit zwangsläufig auch die Glukose-Toleranz.
Darüber hinaus scheint Eisen signifikant negativ den Glukose-Stoffwechsel zu regulieren. In der Tat korreliert der Eisen-Gehalt im Körper sehr stark mit der Inzidenz des metabolischen Syndroms. Offensichtlich kann man die Rolle von Eisen bezüglich der Stoffwechselentgleisung nicht abstreiten.
Eisen reguliert negativ die Glukose-Transporter und andere Systeme des Glukose-Stoffwechsels. Umgekehrt kann eine Eisen-Restriktion den Glukose-Stoffwechsel deutlich (!) verbessern.
Hier postuliere ich nun zum ersten Mal, dass Eisen-Restriktion ein probates Mittel zu sein scheint, um metabolische Entgleisungen zu verhindern oder gar zu „heilen”.
Kleines Aber: Restriktion, ohne dass tatsächlich ein Mangel eintritt. Nun weiß ich, dass man die Fettleibigkeit nicht nur in einem „backward”-Modus „heilen” kann (also durch Restriktion von Eisen), sondern gerade auch durch einen „forward”-Modus (mehr Eisen für höhere oxidative Kapazität) – doch bei letzterer Intervention besteht die Gefahr, dass die Glukose-Toleranz sich derart verschlechtert, dass Fettsäuren das Primärsubstrat sein müssen. Aber … das ist es für viele sowieso schon.
Die Qual der Wahl.
Übersetzt in unser Leben könnte das dann so aussehen: Je höher der Eisen-Gehalt im Körper, umso wahrscheinlicher wird die metabolische Entgleisung hin zum Diabetes*:
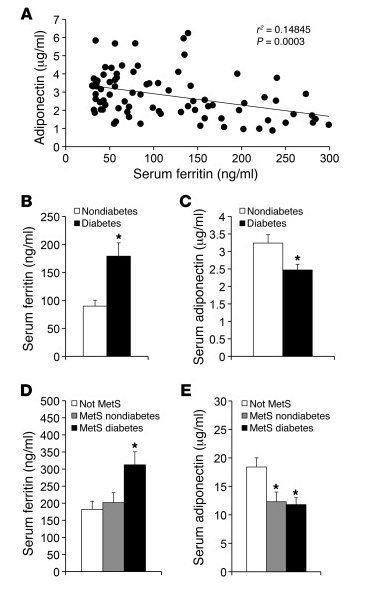
(Bei der Korrelation von Ferritin mit Diabetes muss man aufpassen, weil chronische Entzündungen im Körper auch zur Ferritin-Anreicherung führen. Aufpassen also im Sinne von: Kausalität nicht verwechseln.)
Wer aufgepasst hat: Das gilt nur dann, wenn man Glukose (also Kohlenhydrate) essen will. Denken wir doch einmal an unseren Einzeller. Der entscheidet sich – metabolisch betrachtet – auch für ein Substrat.
Eisen: Toxin und Stoffwechselregulator
Wissenschaftler glauben heute zurecht, dass Eisen ein Kandidat ist, den man im Auge behalten sollte. Aber manche Forscher sagen auch, richtigerweise, dass Eisen eben ein Stoffwechsel-Regulator ist, wie hier gezeigt.
Mit Blick auf den Stoffwechsel sollte man sich dann vielleicht vor Augen führen, dass ein hoher Eisengehalt im Körper nicht oder nur sehr bedingt mit einer guten Glukose-Toleranz vereinbar ist.
Und schon haben wir ein Rätsel gelöst: Wieso können viele Völker viele Kohlenhydrate essen? Die essen reziprok dazu vermutlich sehr viel weniger Fleisch und haben sehr viel mehr Phytinsäure in ihrer Nahrung, das Eisen bindet und ausschwemmt. Auch dieser Vorgang ist bei einigen in der Paleo-Welt negativ besetzt. Phystinsäure = böse. Nein, in diesem Kontext überhaupt nicht. Solange der Eisengehalt im Körper adäquat bleibt, ist das hier – wie gezeigt – sehr passend.
Um noch einmal auf die oben angeführten Trainingsguide-Inhalte zurückzukommen: Viele meiner Leser lesen auch woanders und sind fest davon überzeugt, dass der Ferritin-Wert nicht hoch genug sein kann. In meinen Augen ein fataler Gedanke – zumindest dann, wenn man insulinsensitiv sein möchte.
Extrem hohe Ferritin-Werte? Nicht zielführend
Nur um eine Sache zu erklären: Das meiste Eisen lagert im Hämoglobin (über 60 %), dann kommt Ferritin mit 30 %. Myoglobin macht nur noch 3,5 % aus und die anderen Häm-Enzyme (Cytochrome und so weiter) 0,5 %.
Wenn man über diese Verteilung nachdenkt, sollte klar werden, warum es keinen Sinn ergibt, den Ferritin-Wert ins Endlose steigern zu wollen. Wenn der Ferritin-Wert deutlich ansteigt, sollten alle anderen Eisen-Systeme längst abgesättigt sein.
Wie tief ist zu tief?
Anthony Colpo hat dazu ausgiebig Erfahrungen gesammelt. Er selbst sagt, dass sich sein Glukose-Stoffwechsel ganz dramatisch verbessert hat, nachdem er seine hohen Ferritin-Werte mit Phlebotomie gesenkt hat.
Und er berichtet auf seiner Seite auch, wann es zu viel des Guten war:
Als ich meinen Ferritin-Wert unter 30 senkte, begann ich mich während und nach Bike-Touren müde zu fühlen. Nachdem ich den Wert auf 40 anhob, war wieder alles in Ordnung.
Ein Ferritin-Wert von 30 und 40 ist eine Liga für sich und eine Gratwanderung, versteht sich. Man sollte immer bedenken, dass so etwas hoch individuell sein kann – manche kommen mit solchen Werte kaum noch aus dem Bett (die werden sicher gleich diesen Artikel kommentieren). Andere, wie Anthony Colpo, fahren damit hervorragend.
Im Anhang findest du zum weiterlesen eine Literatur-Liste.
Weiterführende Literatur
Interessant ist der Artikel bei Free The Animal – hauptsächlich für die englisch verstehenden Deutschen. Der Autor dort schrieb einen lesenswerten Artikel nieder, wenngleich diese Extrapolation durchaus etwas zu weit geht – meiner Meinung nach.
Ansonsten, auch lesenswert, wie immer, die Quellenangabe wie folgt.
Literatur
Choi, Joo Sun; Koh, In-Uk; Lee, Hyo Jung u. a. (2013): „Effects of excess dietary iron and fat on glucose and lipid metabolism“. In: The Journal of Nutritional Biochemistry. 24 (9), S. 1634-1644, DOI: 10.1016/j.jnutbio.2013.02.004.
Cooksey, Robert C et al. „Dietary iron restriction or iron chelation protects from diabetes and loss of β-cell function in the obese (ob/ob lep−/−) mouse.“ American Journal of Physiology-Endocrinology And Metabolism 298.6 (2010): E1236-E1243.
Dongiovanni, Paola et al. „Dietary iron overload induces visceral adipose tissue insulin resistance.“ The American journal of pathology 182.6 (2013): 2254-2263.
Fargion, Silvia et al. „Hyperferritinemia, iron overload, and multiple metabolic alterations identify patients at risk for nonalcoholic steatohepatitis.“ The American journal of gastroenterology 96.8 (2001): 2448-2455.
Farrell, Peter A, John L Beard, and Marlin Druckenmiller. „Increased insulin sensitivity in iron-deficient rats.“ The Journal of nutrition 118.9 (1988): 1104-1109.
Fernández-Real, José Manuel, Abel López-Bermejo, and Wifredo Ricart. „Cross-talk between iron metabolism and diabetes.“ Diabetes 51.8 (2002): 2348-2354.
Gabrielsen, J Scott et al. „Adipocyte iron regulates adiponectin and insulin sensitivity.“ The Journal of clinical investigation 122.10 (2012): 3529.
Haurie, V.; Boucherie, H.; Sagliocco, F. (2003): „The Snf1 Protein Kinase Controls the Induction of Genes of the Iron Uptake Pathway at the Diauxic Shift in Saccharomyces cerevisiae“. In: Journal of Biological Chemistry. 278 (46), S. 45391-45396, DOI: 10.1074/jbc.m307447200.
Huang, J.; Jones, D.; Luo, B. u. a. (2010): „Iron Overload and Diabetes Risk: A Shift From Glucose to Fatty Acid Oxidation and Increased Hepatic Glucose Production in a Mouse Model of Hereditary Hemochromatosis“. In: Diabetes. 60 (1), S. 80-87, DOI: 10.2337/db10-0593.
Kim, Jonghan et al. „Iron loading impairs lipoprotein lipase activity and promotes hypertriglyceridemia.“ The FASEB Journal 27.4 (2013): 1657-1663.
Minamiyama, Yukiko et al. „Iron restriction improves type 2 diabetes mellitus in Otsuka Long-Evans Tokushima fatty rats.“ American Journal of Physiology-Endocrinology and Metabolism 298.6 (2010): E1140-E1149.
Piperno, Alberto et al. „Increased serum ferritin is common in men with essential hypertension.“ Journal of hypertension 20.8 (2002): 1513-1518.
Schiffer, Tomas A; Larsen, Filip Jon; Ekblom, Björn u. a. (2010): „Mitochondrial Oxygen Affinity Predicts Basal Metabolic Rate in Humans“. In: Free Radical Biology and Medicine. 49 , S. S215, DOI: 10.1016/j.freeradbiomed.2010.10.628.
Valenti, Luca et al. „Iron depletion by phlebotomy improves insulin resistance in patients with nonalcoholic fatty liver disease and hyperferritinemia: evidence from a case-control study.“ The American journal of gastroenterology 102.6 (2007): 1251-1258.
Wrede, CE et al. „Association between serum ferritin and the insulin resistance syndrome in a representative population.“ European Journal of Endocrinology 154.2 (2006): 333-340.

10 comments On Eisen: Mehr Fettverbrennung, aber Insulin-Resistenz und Diabetes?
Weshalb sollten die Rhagaden und die trockene Haut mit dem Ferritin von 70 in Verbindung stehen?
Üblicherweise treten echte Mangelerscheinungen erst bei einem Ferritin unter 15, vielleicht im Graubereich 15-30 ng/ml auf.
Deine Symptome passen definitiv zu der diabetischen Stoffwechsellage. Wie ist hier die Einstellung von BZnü, BZ 2h postprandial, HbA1c, Triglyceriden?
Auch die Schilddrüse könnte ein Kandidat für zu trockene rissige Haut sein.
Ferner kommen Verschiebungen der Fettsäuren (v.a. Defizite z.B. bei y-Linolensäure oder Arachidonsäure) in Frage.
Grüsse
Was wäre denn ein zu hoher Wert bzgl. Diabetes?
Mein Wert ist 70 und ich habe jetzt schon Rhagaden und trockene Haut.
Mein Hausarzt ist der Meinung, dass bei solch einem niedrigen Wert (haha) die Hämochromatose ausgeschlossen ist, ohne Gen-Test (ist das nicht ein genialer Arzt?!) kostet ja alles; er hat bisher auch keine Entzündungswerte geprüft. Ich stecke so ziemlich in der Sch…, habe aber jetzt die Artikel zum Thema ausgedruckt (mit Diskussion) und nehme sie mit zum nächsten Arztbesuch. Die Untersuchung von Transferrin und -Sättigung werde ich auch verlangen.
Das fällt schwer nachzuvollziehen! Ferritin uber 500 ist immer Anlass an eine HC zu denken.
Im Zweifel ab in die nächste innere Abteilung des nächsten Krankenhauses! Abklären lassen!
Grüße
Hi, ich hatte es bereits bei einem Facebook Beitrag von edubily postuliert, habe seit zwei Jahren hohe Ferritin-Werte so um die 500, mein HbA1C-Wert hat sich kontinuirlich verschlechtert – wird aber auch nicht mehr besser, trotz Low Carb, abgenommen habe ich während meiner Fastenzeit auch nur sehr wenig. Gehe jetzt Blut spenden, weil mein Hausarzt den Aderlass ablehnt. Vesrtehe den Zusammenhang von Diabtes und Ferritin immer besser. Danke für die Ausführungen.
Eine Hämochromatose (Eisenspeicherkrankheit) wurde bei Dir ausgeschlossen?
Gibt es Gründe für diese hohen Werte? Systemischer Entzündungen ? (Crp, BSG, pCT-Bestimmungen?
Gibt es Werte von Transferrin und Transferrin-Sättigung als Hinweise auf eine Verteilungsstörung DD echter Überschuss ?
So ein hohes Ferritin ist wahrlich ein Problem!
Ich hatte vor ca. 1 Jahr meine (gesamten) Werte kontrollieren lassen, Ferritin war auf 18, Gesamteisen war im unteren mittleren Bereich. Ich hatte bei meiner Diät, die im Jänner angefangen hat, massive Probleme Fett abzubauen, mit der Energie im Training war ich eigentlich zufrieden (bin zumindest nicht ins Studio gekrochen oder habe mich schwach gefühlt).
Es wäre interessant, inwieweit die hier beschriebenen Vorgänge darauf Einfluss hatten.
Meine Ernährung umfasst fast gar kein Gemüse, dafür als Beilagen oft Nudeln und Reis (Phytinsäure). Es wäre vielleicht eine gute Idee, das Verhältnis mal etwas auszugleichen, und zu schauen, was passiert.
Die Frage ist auch, wie schnell sich der Körper umstellen kann. Ansonsten könnte man ja am Anfang einer geplanten Abnehmphase (Diät klingt etwas ausgelutscht) auf hohe Eisenwerte setzen (forciert) und mit zunehmender Fettabnahme das Eisen wieder zurückfahren bzw mehr Phytinquellen einschleusen (Weizen und Reisprodukte) –> im Grunde genommen, was sowieso gepredigt wird, je geringer der KFA, desto mehr Kohlenhydrate sollens sein :D
Aha!
Blöd das bei meiner Blutuntersuchung, nach Lesen des Handbuchs, Ferritin vergessen wurde. Das hätte mich jetzt mal interessiert. Wird beim nächsten mal auf jeden Fall überprüft.
Schöner Artikel.
Würde noch Transferrin und Transferrin-Sättigung bestimmen lassen um eine valide Aussage über den Eisenstoffwechsel im Körper zu haben!
Ich habe mich gewundert, warum ich immer nach Eisen-Einnahme extremen Heißhunger bekomme und weiche Knie, wie als wäre ich im Unterzucker.
Ist das weil mein Wert nun so hoch ist? Könnte ich dann Diabetes bekommen?
Mein Ferritinwert war beim letzten Mal 111. War vor 2 Jahren 7, deswegen musste ich Eisen nehmen, wegen starker Periode nehme ich es noch, um den Wert zu halten.