Ich möchte heute einen Artikel präsentieren, der nicht von mir stammt, sondern von einem (anderen) Biologen. Da ich die Zukunft plane, pflege ich Kontakte zu anderen talentierten Personen, die gewisse Visionen, Ideen und Gedanken teilen.
Es handelt sich hierbei um Taimes, im realen Leben Tim, der auch bei uns im Forum angemeldet ist. Dort könnt ihr ihn auch kontaktieren, falls ihr fragen habt.
In seinem Artikel bespricht Taimes, wie Fett im Körper verarbeitet wird und zeigt: Fett kommt nicht direkt nach einer Mahlzeit ins Blut, sondern zeitlich verzögert, was auch Implikationen für dich haben könnte, wenn du dir über dein Zufuhr timing Gedanken machst.
Postprandiale Lipämie – Fette spielen “Reise nach Jerusalem”
Welches Fett zirkuliert wann in meinem Körper?
Im Zeitalter des low carb Hypes stimmen viele Ernährungsbewusste inzwischen darin überein, dass der Anteil der Kohlenhydrate mehr oder weniger stark reduziert werden sollte. Logischerweise müssen dann gleichzeitig die Kalorien aus dem Nahrungsfett erhöht werden.
Ob (oder für wen) diese Ernährungsform jetzt “gut” beziehungsweise “schlecht“ ist, sei an der Stelle mal dahin gestellt…
Fakt ist aber, dass inzwischen enormes Interesse daran besteht, seinen Fettstoffwechsel zu “optimieren” und Nährstoffe “getimed” zuzuführen. Durchaus auch berechtigt, denn die Forschung liefert immer mehr Hinweise dafür, dass ein optimierter Fettstoffwechsel z.B. im Kontext einer Restriktions-Diät bei Übergewichtigen nachgewiesenermaßen sinnvoll in Sachen Gewichtsverlust, Verbesserung der Blutfettwerte, Diät-Einhaltung etc. sein kann.
Das lässt sich unter anderem durch das allseits beworbene low carb oder intermittierende Fasten erreichen. Das bedeutet in meinen Augen allerdings nicht, dass pauschal jeder Gesundheitsbewusste auf diesen Zug aufspringen muss. Bei einem geringen Körperfettanteil und hohem Sportpensum muss das nicht mehr den Königsweg darstellen.
Die aktuelle Forschung unterstützt desweiteren die Annahme, dass es nicht nur darauf ankommt was und wie viel man isst, sondern auch darauf wann.
Sogenannte chronobiologische Aspekte stellen sehr mächtige Determinanten dar, die den Umgang mit Nährstoffen beeinflussen. An dieser Stelle möchte ich die Tatsache erwähnen, dass Nachtschicht-Arbeiter einem erhöhten Risiko ausgesetzt sind metabolischen Erkrankungen zu entwickeln. Das ist wohl der Tatsache geschuldet, dass eine Desynchronisation zwischen den inneren biologischen Taktgebern und dem Essverhalten erzeugt wird.
Mit dieser kurzen Hinführung habe ich versucht Folgendes deutlich zu machen:
Die Betrachtung von low carb Ansätzen sowie Nährstoff-Timing haben ihre Berechtigung, müssen aber trotzdem kontrovers und Kontext–abhängig diskutiert werden. Und hier kommt das Ziel des Artikels direkt hinterher:
Ich will versuchen einen kleinen Einblick in die postprandiale Lipid-Homöostase zu liefern.
Was passiert nachdem ich Fette gegessen habe?
Postprandial = Zustand nach einer Nahrungsaufnahme.
Lipämie = erhöhte Serum-Konzentration an Fett (Lipoproteine).
Bei den beiden Ernährungstrends low carb und Nährstoff-Timing spielt die Lipid-Homöostase eine wesentliche Rolle, dennoch weiß man dazu in der Regel nicht so wirklich viel.
Meine Denkanstöße sollen klar machen, dass du nicht direkt planen kannst wann welche Nährstoffe in deinem Körper zirkulieren. Dies wurde häufig als Frage an mich formuliert im Bezug auf Fischölkapseln, deren timing und wie man diese Fettsäuren “optimal einlagern kann”. Außerdem hoffe ich, dass man Ernährung am Ende nicht mehr nur als die Aneinanderreihung separater Mahlzeiten ansieht, sondern als integratives und dynamisches Zusammenspiel.
Screenshots im nüchternen Zustand
Ich möchte mit ein paar Fakten in Sachen Lipide beginnen, die verglichen mit der Glukose/Insulin-Thematik auf Fitness-Boards oftmals eher stiefmütterlich behandelt werden:
Wenn man sich ein Blutbild anschaut, kennt man vielleicht noch das „böse und das gute“ Cholesterin. Sprich Triglyceride (= Fette), die mit Apolipoproteinen und Cholesterin zu Aggregaten (= Paketen) zusammengebastelt werden. Diese werden dann lapidar gesagt entweder zur Leber hin transportiert („gutes“ HDL) oder von der Leber weg (Atherosklerose-begünstigendes LDL und VLDL).
Möglicherweise weiß man noch darüber, dass neben diesen Aggregaten noch so genannte nicht-veresterte Fettsäuren aus weißen Fettzellen (= freie Fettsäuren; wer gestern aufgepasst hat, der weiß Bescheid) im Blut unterwegs sind (wasserlöslich durch die Bindung an das Transportprotein Albumin).
So ging es mir bis vor Kurzem ungefähr auch noch, bis ich mich dann irgendwann dazu gezwungen habe, mich eingehender mit der Materie auseinander zu setzen. Diese Momentaufnahmen sind sicherlich nette Indikatoren für die allgemeine Gesundheit. Nach Abständen seiner Wahl kann man sich nüchtern Blut abzapfen lassen und daran dann eventuelle Verschiebungen in den Spektren erkennen.
Was passiert über den Tag gesehen? Man ist schließlich nicht immer nüchtern…
Auch ein Fasten-Überzeugter wird schließlich irgendwann etwas essen….Was passiert dann mit den Blutfetten? Was passiert bei mehreren kleinen und was bei wenigen großen Mahlzeiten? Wie wirken carbs auf die Blutfettwerte?
Alles Themen, die eher einem real-world Szenario entsprechen.
Ich möchte den Fokus darauf legen, wie flexibel der Körper bei der Nahrungsaufnahme eine Lipid-Repartitionierung durchführt – sprich Fett von einem Speicher in einen anderen umverteilt.
Interessanterweise passiert diese Umverteilung auch, wenn im Augenblick der Betrachtung quasi kein Fett im Essen enthalten ist.
Ist dein fettfreier backload (= Kohlenhydrat refeed) vielleicht gar nicht so fettfrei?!
Das folgende ist wohl gerade für CBLer (= Leute, die „Carb Back Loading“ praktizieren) oder IF’ler (= Leute, die intermittierendes Fasten praktizieren) ein recht interessantes Phänomen:
Während des Fastens ist der Insulinspiegel bekanntlich sehr niedrig und die Lipolyse läuft auf Hochtouren (=viele Fettsäuren werden ins Blutplasma abgegeben).
Viscerales Fettgewebe reagiert am empfindlichsten auf niedrige Insulin- bzw. hohe Catecholamin-Spiegel. Aufgrund der anatomischen Lage, gelangen die im Bauchraum freigesetzten Fettsäuren direkt zur Leber.
Mit fortlaufender Fastendauer werden die hepatische Glykogenspeicher immer stärker reduziert. Dieser Engpass wird dem Gehirn über autonome Nervenfasern übermittelt, welches seinerseits über Nervenfasern die Freisetzung von Fettsäuren aus dem Depotfett zusätzlich verstärkt. Durch diese Leber-Gehirn-Fettzellen Achse wird im Körper ein systemischer Substrat switch induziert.
Als ein zentrales Stoffwechselorgan spielt die Leber für diese Anpassung des gesamten Körpers eine große Rolle. Gleichzeitig muss sie als sehr stoffwechselaktives Gewebe natürlich auch ihre eigene Energieversorgung sicherstellen.
Um beides zu gewährleisten, werden während des Fastens Gene hochreguliert, die am Fettstoffwechsel beteiligt sind. Die Rate der ß-Oxidation wird genauso gesteigert wie die Produktion von Ketonkörpern, welche freigesetzt und von anderen Geweben als schnellerer Energieträger genutzt werden können. Die Lipolyse-Rate während des Fasten übersteigt jedoch die Rate der hepatischen Oxidation – es entstehen Keton-Körper, quasi als „Abfallprodukt“. Um in diesem Mangelzustand versorgt zu sein, nehmen die Leberzellen in ausgeprägter Art und Weise einen Teil der überschüssigen Fettsäuren auf und akkumulieren sie innerhalb von Vehikeln als re-veresterte Triacylglyceride (microvesiculäre ektope Fettspeicherung).
Die Leber also stellt eine Art Puffer-Organ dar und betreibt während des Fastens eine Zwischenspeicherung an Fett.
Die Leber eines fastenden Nagers erscheint gelblich bzw. ”fettig”. Das ist sogar mit bloßem Auge ohne Mikroskop erkennbar. Erlaubt man dem Nager etwas zu fressen, wird dieses Leberfett schlagartig ins Blut freigesetzt. Das geschieht in Form von Lipid-Aggregaten (= Fett-Pakete) mit geringer Dichte (VLDL = very low density lipoproteins).
Theoretisch müsste ich hier deutlich weiter ausholen: Generell wird vermutet, dass unter gewissen Umständen diese VLDL-Partikel kardiovaskuläre Risikofaktoren darstellen. Bezüglich der Fasten-induzierten Fettleber ist die Datenlage beim Menschen eher rar. Aller Voraussicht nach ist sie nicht so ausgeprägt wie bei den kleineren Nagetiere. Letztere reagieren in jeder Hinsicht viel empfindlicher auf das Fasten (z.B. auch in Sachen Leptin-Abfall).
Aber auch beim Menschen gilt: VLDL steigt im Blut nach einer Mahlzeit sehr ausgeprägt an. Selbst wenn das Essen kaum Fett enthält, werden diese angestauten Lipid-Aggregate aus der Leber freigesetzt. Im postprandialen Zustand stellen VLDL zahlenmäßig sogar den Löwenanteil der Lipoprotein Partikel in der Zirkulation.
Nahrungszufuhr ist ein Stimulus, der zur plötzlichen Freisetzung der VLDL aus der Leber führt. Trotz der Tatsache, dass die Funktion der Zellen nicht wirklich unter dieser Fasten-induzierten Fettleber leidet, muss man bedenken, dass eine hohe Mahlzeitenfrequenz jedes Mal für einen Anstieg der Blutfette nach dem Essen sorgt.
Auf lange Sicht kann dieser konstante Stimulus – „Es kommt jetzt Nahrung“ – zu Problemen führen wie der nicht-alkoholischen Fettleber (NAFLD), der damit assozierten Insulin Resistenz, Dyslipidämien und kardiovaskulären Problemen, wie Arteriosklerose.
(Anmerkung von Chris: Alle hier genannten Probleme, sind im Prinzip verschiedene Gesichter der selben Gestalt. Das heißt: Fettleber und Insulin-Resistenz bedingen sich gegenseitig, was zwangsläufig zur Dyslipidämie führt und letztendlich in kardiovaskulären Ereignissen resultiert.)
Als ein multifaktorielles Krankheitsbild müssen selbstverständlich gewisse Rahmenbedingungen gegeben (Überkonsum, genetische Prädisposition, sedentärer Lebensstil,…) Die Nahrungszusammensetzung spielt akut ebenfalls eine Rolle und bestimmt, wie stark die Lipämie ausfällt. Unterschiedliche Kohlenhydrate und Proteinen beeinflussen den Anstieg der Blutfette, genauso wie die absolute Fettmenge, der Sättigungsgrad der zugeführten Fettsäuren und problematische Nährstoffkombinationen.
Aufgrund dieser postprandialen Anstiege der Blutfettwerte, ist es meiner Meinung nach anzustreben, ansatzweise in die post-Resorptions-Phase hineinzurutschen.
Ich spreche hier nicht zwangsläufig von langem Fasten, sondern eher von einem entzerrten Essenschema (3 Mahlzeiten pro Tag), was den Körper “wieder neu kalibrieren” lassen kann.
Natürlich hängt dies alles sehr vom individuellen Ernährungs- und Lebensstil ab. Dennoch würde ich hier festhalten:
Iss weniger oft!
Zumindest im Kontext einer hyperkalorischen Ernährung stellte sich eine niedrige Mahlzeiten-Frequenz als weniger problematisch dar als dauerhaft zu snacken (NAFLD-Manifestation). Wurde zucker-und fetthaltiger Süßkram direkt zu den Hauptmahlzeiten gegessen, wirkte sich das weitaus weniger negativ aus als wenn selbiges als Snacks zwischendurch konsumiert wurden. Übergewichtige sollten also definitiv von einem Fasten-Ansatz profitieren.
Leber VLDL ok….und was ist dann mit dem Fett, das ich gerade esse?
Hier wird es ebenfalls etwas Überraschendes zu lesen geben. Vorerst aber eine kurze Zusammenfassung der Basics:
- gegessenes Nahrungsfett (= Triglyceride) wird aufgespalten und emulgiert,
- daraus resultierenden Fettsäuren-Micellen werden von Darmzellen aufgenommen,
- innerhalb der Zellen werden sie wieder verestert (= zusammengefügt) zu Triglyceriden,
- in Form von Chylomikronen (= Triglycerid-Transporter) werden sie in die Lymphe freigegegeben.
Chylomikronen sind – wie die VLDL – weitere Aggregationen (= Pakete), also kugelförmige „Fetttröpfchen“, die durch amphipathische Proteine wasserlöslich gemacht werden. Letztendlich fließen die Chylomikronen in ein großes Lymphgefäß ab – den sogenannte Milchbrustgang. Er heißt so, da er nach einer fetthaltigen Mahlzeit milchig-weiß erscheint.
Er verläuft parallel zur Bauchschlagader entlang der Körperachse nach oben und zieht aus dem Bauch in den Brustraum. Dort treten die Chylomikronen am linken Venenwinkel aus der Lymphe ins Blut über.
1 → 2 → 3 …. wirklich so einfach?
Bei Betrachtung dieser Prozesse hat man vermutlich eine Sequenz von Vorgängen vor Augen, welche einfach nacheinander ablaufen.
An dieser Vorstellung könnte man auch festhalten, wenn man sich den klassischen Graphen der postprandialen Lipämie anschaut. Hier erkennt man immer einen typischen „early peak“ an Triglyceriden.
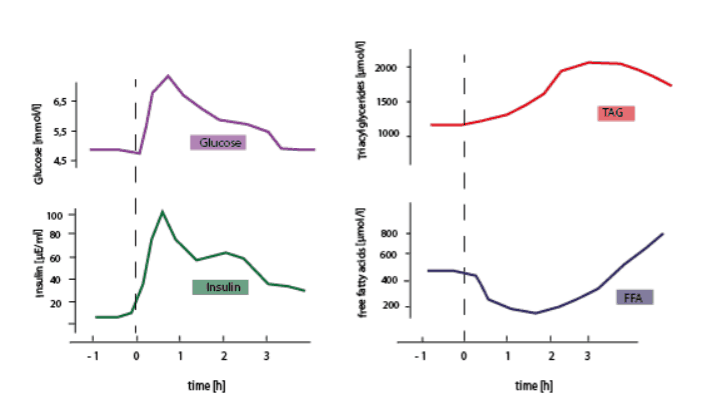
(Anm. von Chris: Normalerweise „schleust“ Insulin Triglyceride in die Zellen. Heißt: Steigt Insulin, dann fallen Triglyceride i.d.R. ab, genau wie aus dem Fettgewebe freigesetzte „freie Fettsäuren“. Daher der oben typische Verlauf: Glukose steigt, Insulin steigt, Triglyceride fallen (oder bleiben niedrig) und freie Fettsäuren fallen, bis sie nach dem Verschwinden von Insulin direkt wieder ansteigen)
Schön und gut… bis Fett im Blut ist dauert es einfach etwas länger als bei Glucose. Was ist daran jetzt spektakulär?
Folgende Überlegung:
Was ist aber, wenn Fettspaltung, Resorption und Freisetzung nicht einfach nur etwas langsam ist? Was, wenn zwischendurch ein wirklicher Dornröschenschlaf einlegt?
Tatsächlich sprechen sehr viele Hinweise dafür, dass eine ausgeprägte Zwischenspeicherung des Nahrungsfettes in den Darmzellen stattfindet. Zur Erinnerung: In Darmzellen werden die Fettsäuren wieder zu Triglyceriden re-verestert und in Vesikeln gespeichert. Mit der Freisetzung in den Milchbrustgang lässt sich die Darmzelle aber ganz offensichtlich sehr viel Zeit.
Woher stammt das ganze Blutfett nach einer Mahlzeit?
Ganz einfach: Aus den vorherigen Mahlzeiten.
Konsumiert man etwas Fetthaltiges wird der Großteil dieses Fetts in den Darmzellen zwischengespeichert, zurückgehalten und erst auf den nächsten Stimulus in die Lymphe freigesetzt (second meal effect).
Die Studien dazu sind alle ziemlich ausgefuchst und arbeiten mit verschieden markierten Fettsäuren, die dann zu den jeweiligen Mahlzeiten gegessen werden. Hierdurch wurde immer offensichtlicher, dass das „one meal model“ in keinsterweise das normale Essverhalten mit seinen ernährungsphysiologischen Zuständen widerspiegelt.
Eine relativ fettarme Mahlzeit genügt auch hier, um die Freisetzung dieser TAG-Speicher zu bewirken. Ich konnte selbst die Beobachtung machen, dass man in Ratten nach einer fettarmen Mahlzeit in der Lymphe des Milchbrustganges Chylomikronen-Triglyceride nachweisen kann.
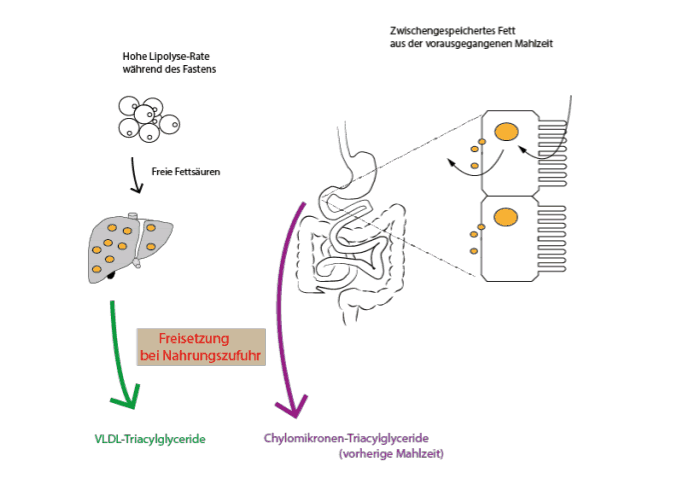
Die Abbildung zeigt sehr schön das, was bisher besprochen wurde: Sowohl VLDL-Triglyceride aus der Leber, als auch „zwischengespeichertes Nahrungsfett“ aus Darmzellen, werden nach Mahlzeiten freigesetzt. Bei Letzterem muss man sich allerdings fragen: Aus welcher Mahlzeit?
Regelmäßiger Sport – Die effektivste Strategie um starke Bluttfett-Anstiege zu vermeiden
Im Menschen und in Tiermodellen wurde der Trainingsstand mehrfach mit einem besseren Handling von Blutfetten und Fettsäuren in Verbindung gebracht. Die hohe mitochondriale Aktivität und oxidative Kapazität schützen vor einer Fettleber.
(Anm. von Chris: Ein Muskel, der eine hohe Kapazität hat, Fettsäuren zu oxidieren, der möchte auch gerne mit Fettsäuren versorgt werden. Daher finden wir dort – also bei diesen Muskeln – vermehrt das Enzym Lipoprotein-Lipase, das Fette spaltet. Die gewonnen Fettsäuren werden somit nicht im Fettgewebe gespeichert, sondern im Muskel oxidiert. Auch Fasten oder Sport sorgt für erhöhte LPL-Expression)
Selbst akut kann Sport das Nährstoff-Handling verändern und hierfür möchte ich am Ende des Artikels noch kurz das Schlachtfeld wechseln. Die meisten Sportler wissen von der insulin-unabhängigen GLUT4-Translokation und dem verringerten Insulin-Bedarf nach Widerstandstraining. Das bedeutet, ich habe weniger starke Blutzuckeranstiege, richtig? Nun ja, es kommt darauf an…
Im nächsten Teil (Artikel 2) wird es an dieser Stelle weitergehen.
Take home messages
- Nahrungszufuhr bewirkt unweigerlich eine Re-Organisation von Fettreserven aus der Leber und dem Darm,
- deshalb kommt es zu einem Anstieg der Blutfette nach dem Essen,
- durch Sport, bestimmte Makro-und Mikronährstoffe und dem Vermeiden einer hohen Mahlzeitenfrequenz, kann eine gewisse Repartitionierung hervorgerufen werden.
Exkurs
Anmerkung zur Abb. 1: Neben der Veranschaulichung des TAG-Anstiegs (1-4h) möchte ich das Augenmerk auf die freien Fettsäuren (FFA) lenken. Hier liegt eine inverse Beziehung vor, denn die Lipolyse wird nach der Nahrungszufuhr gehemmt. Sobald TAG-haltige Lipoproteine zirkulieren, muss die Fettzelle schließlich nicht auch noch Fettsäuren freisetzen, sondern sollte vielmehr als ein Lipid-Abnehmer. Freie Fettsäuren reduzieren unter anderem auch die Insulin-Sensitivität, Glukose-Aufnahme und – Oxidation (Randle Cylce).
Folglich ist eine gehemmte Lipolyse (= Freisetzung von freien Fettsäuren) auch für eine normale Glukose-Homöostase essentiell und es ist ein Zeichen für Gesundheit, wenn im postprandialen Zustand die Konzentration an Fettsäuren abfällt.
Die Lipolyse (genauer die Hormon-sensitiven Lipase) wird übrigens nicht ausschließlich durch Insulin und high carb Ernährung abgeschalten, wie low carb Werbeslogans oftmals vermuten lassen.
Auch durch Fett wird dieses zentrale Enzym inhibiert. Dementsprechend verhindert auch ein low carb Snack die Freisetzung deines körpereigenen Fetts.
Wie bereits angesprochen, ist es ein Zeichen für Gesundheit, wenn die Fettsäure-Freisetzung (aus dem Fettgewebe) durch Insulin unterdrückt wird. Diese Mechanismus greift bei Insulin-Resistenten und (Prä-)Diabetikern nicht mehr und wir finden konstant zu viele freie Fettsäuren. Niacin bzw. Vitamin B3 kann hier echte Dienste leisten, denn es hemmt die Fettsäure-Freisetzung aus dem Fettgewebe, was – angelehnt an den Randle Cycle – dafür sorgt, dass wir ordentlich Glukose oxidieren können.
Der second-meal Effekt hat auch bei der Glukose-Homöostase seine Finger mit im Spiel. Fette und Glucose mögen sich nicht unbedingt und antagonisieren sich zum Teil stark (gehemmte Insulin-Wirkung, Randle Cycle).
Deswegen überrascht es nicht: Je weniger Fett du in der vorherigen Mahlzeit gegessen hast, um so besser ist deine Insulin-Sensitivität, das heißt, die Fähigkeit zur Glukoseaufnahme und – oxidation.
Heißt, der Blutzuckerspiegel nach dem Mittagessen dankt dir ein fettarmes Frühstück. Gleichermaßen beeinflusst auch das Abendessen wie du am nächsten Morgen mit Kohlenhydraten umgehst – auch nach ca. 12h Schlaf mit Nahrungskarenz!
Anm. von Chris:
Der Artikel soll euch sagen…
Willst du Fette und Kohlenhydrate bedenkenlos an einem Tag (getrennt) zuführen, dann bedenke den second meal effect => Es befindet sich womöglich noch Fett in deinem Darm!
Referenzen
Abumrad, Nada A, and Nicholas O Davidson. „Role of the gut in lipid homeostasis.“ Physiological reviews 92.3 (2012): 1061-1085.
Björkegren, Johan et al. „Differences in apolipoprotein and lipid composition between human chylomicron remnants and very low density lipoproteins isolated from fasting and postprandial plasma.“ Journal of lipid research 39.7 (1998): 1412-1420.
Bjorkegren, J et al. „Accumulation of large very low density lipoprotein in plasma during intravenous infusion of a chylomicron-like triglyceride emulsion reflects competition for a common lipolytic pathway.“ Journal of lipid research 37.1 (1996): 76-86.
Chong, Mary FF, Barbara A Fielding, and Keith N Frayn. „Metabolic interaction of dietary sugars and plasma lipids with a focus on mechanisms and de novo lipogenesis.“ Proceedings of the Nutrition Society 66.01 (2007): 52-59.
Cohn, Jeffrey S et al. „Contribution of apoB-48 and apoB-100 triglyceride-rich lipoproteins (TRL) to postprandial increases in the plasma concentration of TRL triglycerides and retinyl esters.“ Journal of lipid research 34.12 (1993): 2033-2040.
Daoud, Emilie, Celena Scheede-Bergdahl, and Andreas Bergdahl. „Effects of Dietary Macronutrients on Plasma Lipid Levels and the Consequence for Cardiovascular Disease.“ Journal of Cardiovascular Development and Disease 1.3 (2014): 201-213.
Evans, Kevin, Mo L Clark, and Keith N Frayn. „Effects of an oral and intravenous fat load on adipose tissue and forearm lipid metabolism.“ American Journal of Physiology-Endocrinology And Metabolism 276.2 (1999): E241-E248.
Fielding, Barbara. „Tracing the fate of dietary fatty acids: metabolic studies of postprandial lipaemia in human subjects.“ Proceedings of the Nutrition Society 70.03 (2011): 342-350.
Fielding, Barbara A et al. „Postprandial lipemia: the origin of an early peak studied by specific dietary fatty acid intake during sequential meals.“ The American journal of clinical nutrition 63.1 (1996): 36-41.
Guan, Hong-Ping et al. „Accelerated fatty acid oxidation in muscle averts fasting-induced hepatic steatosis in SJL/J mice.“ Journal of Biological Chemistry 284.36 (2009): 24644-24652.
la Fleur, SE et al. „The snacking rat as model of human obesity: effects of a free-choice high-fat high-sugar diet on meal patterns.“ International Journal of Obesity (2013).
Izumida, Yoshihiko et al. „Glycogen shortage during fasting triggers liver–brain–adipose neurocircuitry to facilitate fat utilization.“ Nature communications 4 (2013).
Koopman, Karin E et al. „Hypercaloric diets with increased meal frequency, but not meal size, increase intrahepatic triglycerides: A randomized controlled trial.“ Hepatology (2014).
Lairon, D. „Nutritional and metabolic effects of postprandial lipemia.“ (1996).
Mustonen, Anne-Mari et al. „Manifestations of Fasting-Induced Fatty Liver and Rapid Recovery from Steatosis in Voles Fed Lard or Flaxseed Oil Lipids.“ Nutrients 5.10 (2013): 4211-4230.
Mustonen, Anne-Mari et al. „Fatty acid mobilization in voles—Model species for rapid fasting response and fatty liver.“ Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology 163.1 (2012): 152-160.
Sato, Maki et al. „Acute effect of late evening meal on diurnal variation of blood glucose and energy metabolism.“ Obesity research & clinical practice 5.3 (2011): e220-e228.
Schneeman, Barbara O et al. „Relationships between the responses of triglyceride-rich lipoproteins in blood plasma containing apolipoproteins B-48 and B-100 to a fat-containing meal in normolipidemic humans.“ Proceedings of the National Academy of Sciences 90.5 (1993): 2069-2073.
Silva, KDRR et al. „Meal ingestion provokes entry of lipoproteins containing fat from the previous meal: possible metabolic implications.“ European journal of nutrition 44.6 (2005): 377-383.
Szendroedi, Julia et al. „Lower fasting muscle mitochondrial activity relates to hepatic steatosis in humans.“ Diabetes care 37.2 (2014): 468-474.
Robertson, MD et al. „Mobilisation of enterocyte fat stores by oral glucose in humans.“ Gut 52.6 (2003): 834-839.
Robertson, M Denise et al. „Extended effects of evening meal carbohydrate-to-fat ratio on fasting and postprandial substrate metabolism.“ The American journal of clinical nutrition 75.3 (2002): 505-510.
Tholstrup, Tine et al. „Effect of 6 dietary fatty acids on the postprandial lipid profile, plasma fatty acids, lipoprotein lipase, and cholesterol ester transfer activities in healthy young men.“ The American journal of clinical nutrition 73.2 (2001): 198-208.
Zilversmit, Donald B. „Atherogenesis: a postprandial phenomenon.“ Circulation 60.3 (1979): 473-485.
Zhang, John Q, Tom R Thomas, and Stephen D Ball. „Effect of exercise timing on postprandial lipemia and HDL cholesterol subfractions.“ Journal of Applied Physiology 85.4 (1998): 1516-1522.

8 comments On Fette Eigenschaften: Vordenkern zuhören!
Eine kleine Ergänzung noch in Sachen oxidative Kapazität, Verbrennung von Fettsäuren, die Rolle der Muskulatur etc
Das alles hat Chris ergänzt und er liegt richtig damit.
Trotzdem gibt es ein weiteres wichtiges Organ, dessen oxidative Kapazität sehr anpassungsfähig scheint. Es ist damit sehr bedeutend für (a) gesunde Blutfettwerte und (b) für die Aufrechterhaltung eines gesunden Körpergewichts.
Es ist die Darmschleimhaut selbst!
Ein sehr großes Organ mit vielen Zellen. Oft nur als „Schleuser“ angesehen, benötigt es natürlich auch selbst Nährstoffe. Gerade auch, da der Turn-over an Darmzellen sehr hoch ist (Lebensdauer einzelner Zellen nur einige Tage da Kontakt mit allem möglichen Kram von außen)
Es wird spekuliert, dass Individuen mit der Möglichkeit ihre oxidative Kapazität in Darmzellen hochzufahren relativ geschützt sind vor Adipositas. Wenn Darmzellen vermehrt auf Fettsäuren umstellen und diese right-away oxidieren bleibt natürlich auch weniger für die Fettzellen
(und der von Chris erwähnten Muskulatur wird etwas Oxidation-Arbeit von den Schultern genommen)
Auch eine nicht so gängige Überlegung
Gibts denn auch Erkenntnisse wie man die oxidative Kapazität der Darmzellen erhöhen kann?
Und noch eine zweite Frage: kann man sagen wie gross der Stimulus ausfallen muss um die Freisetzung der gespeicherten Fettsäuren auszulösen? Reicht dazu ein Eiweißshake, oder vielleicht sogar einfach ne Tasse Kaffee?
heißt das es wäre vorteilhafter nach paar Low-carb-Tagen, mehrere Stunden(10-20h), vor dem Refeed(mit vorrausgehendem Deplet-Workout) zu fasten (bzw möglichst wenig Fett zuzuführen) um die Glykogenspeicher besser zu füllen und weniger der Carbs in Fett zu verwandeln??
Naja…eine Umwandlung von Carbs in Fett sollte in dem von dir genannten Kontext kaum auftreten.
Man könnte das Bedenken äußern, der Darm würde „mit Fett aufgeladen“ durch die LC/HF Phase zuvor. Wie bei einem gespanten Bogen würde es dann bei einem Carb Refeed freigesetzt und in Kombination mit Insulin bevorzugt in Fettzellen eingelagert werden.
Hier sei daran erinnert, dass Insulin sehr ausgeprägt die Lipoprotein-Lipase im Fettgewebe aktiviert. Die LPL im Muskel ist nicht so strikt davon reguliert, wie Chris in meinem Artikel ergänzt hat.
Da du aber ein Workout am selben Tag hast, kann man wohl davon ausgehen, dass diese Freisetzung sehr milde ausfallen wird und die LPL Aktivität im Muskel schon sehr aktiv ist. Kommt natürlich auch auf die Art des Trainings an.
Und nicht nur akutes Training, auch regelmäßiger Sport lässt die Bedeutung dieser Geschichte wohl weniger tragisch werden.
Alles in allem soll dieser Artikel auch nicht als „Guide“ angesehen werden sondern als „Anti-Guide“…
Es soll zeigen, dass vieles schlecht zu kalkulieren ist und man auch ein wenig Kontrolle abgeben sollte. Körpergefühl und Intuition verbunden mit regelmäßigem Sport, viel Alltagsbewegung und hochwertigen, unverarbeiteten Lebensmitteln sind der Schlüssel
Genaue Strategien zum Nährstofftiming sind in meinen Augen zum größten Teil vergebliche Liebesmüh
Ergänzend dazu vielleicht noch:
Ich dachte vorhin… Man könnte im Prinzip, der Einfachheit halber, einen Graphen vorstellen. Die gegessene Fettmenge würde dann direkt zusammenhängen mit der Pause, die man einlegen müsste, damit das Fett nicht zu stark ansteigt bei der nächsten Mahlzeit.
Oder anders ausgedrückt: Je mehr carbs du in der nächsten Mahlzeit essen willst, umso weniger Fett sollte die vorherige Mahlzeit beinhalten. Je mehr Fett du gegessen hast, umso größer sollte die Pause ausfallen, falls geplant ist, carbs zu refeeden oder zu essen.
Heftig! Genau diese Gedanken verfolgte ich seit einiger Zeit, und versuchte die Zusammenhänge im Selbstexperiment „zu erspüren“. Alleine die Tatsache, daß Fette eben bekanntlich über ein gesondertes System aufgenommen werden, ließ mich dunkel ahnen, was hier in aller Klarheit (endlich!) dargelegt wurde. Ein riesiges Danke, genau dieses Wissen habe ich gebraucht.
Wie längte hält dann der Secondmeal Effekt wirklich an? Wäre der nach 14-16h hinfällig, dann ergäbe sich für mich folgendes Bild. 14-18 Fasten, am Mittag grosse Portion KH, gegen Abend hin Fett & Protein.
Somit sollte das gespeicherte Fett am wenigsten Probleme machen, wenn erst wieder 14-18h nach der letzten Mahlzeit grosse mengen KH gegessen werden.
Lg Simu
Dieser second-meal-effect hält definitiv für mehrere Stunden an. Mindestens 4-6h.
Erwähnte Studien mit markierten Fettsäuren arbeiteten aber nicht über so lange Zeiträume, die du gerne gesehen hättest.
Ich würde dennoch spekulieren, dass der second-meal-effect bzw das Fett aus einer vorausgegangen Mahlzeit recht unabhängig von der dazwischenliegenden Zeit einen Einfluss hat.
So gibt es zB Studien, die eine verschlechterte Glucose Toleranz am Morgen darstellen können, wenn am Abend zuvor eine sehr fetthaltige Mahlzeit gegessen wurde (vgl mit einer fettarmen)
Wie im Artikel geschrieben – es ist wohl noch alles viel komplexer und dynamischer als man vermutet