Dieser Beitrag ist auf unserer Facebook-Wall erschienen und widmet sich in aller Kürze der Insulinresistenz.
1. Ketogene Diäten induzieren eine physiologische Insulinresistenz. Das ist normal und für den Zustand förderlich. Ändert aber nichts daran, dass es eine Insulinresistenz ist.
2. Eine pathologische Insulinresistenz ist ein Mix aus systemischer Low-Grade-Entzündung, Abkömmlingen von Lipid-Spezies und unvollständig verbrannten Derivaten ( = niedrige oxidative Kapazität) und einer Fettmasse, vor allem viszeral, die zu viel Fettsäuren abgibt (Spill-over bei immer größer werdenden Fettmassen oder einer Fett-Diät). Kann man messen, haben wir im Stoffwechselbuch genau hingeschrieben. Hierzu ergänzt sich der Randle-Cycle, wobei eine zu dominante, ungebremste Oxidation von Fettsäuren den KH-Stoffwechsel unterdrückt.
3. Die Downregulation von Insulinrezeptoren aufgrund einer konstanten Insulin-Flut ist ein Sekundärphänomen, passiert dann, wenn die Zellen bereits nicht mehr ausreichend auf das Hormon reagieren.
4. Insulinresistenz entsteht eben nicht, weil jemand Kohlenhydrate isst. Kohlenhydrate sorgen zwar für eine Insulinausschüttung, aber a) analog dazu wird der Glukose-Stoffwechsel in der Zelle besser ( = weniger Insulin nötig) und b) eine Insulin-Ausschüttung per se sorgt nicht direkt für ein Herunterregulieren der Rezeptoren (s. Punkt 3). Das leben uns Populationen auf Kitava, den Blue Zones, die Tsimane und andere übergesunde „Wundervölker“ vor, die sich in der Hauptsache von Kohlenhydraten ernähren. Ohne abzuschweifen sei allerdings gesagt, dass der Ballaststoffgehalt von Kohlenhydrat-Quellen auch eine wichtige Rolle spielt, denn die im Darm entstehenden kurzkettigen Fettsäuren gaukeln der Zelle Nahrungsknappheit vor und aktivieren sie via AMP/ATP-Ratio den Masterregulator AMPK + Glukose-Aufnahme. Nannten wir in verschiedenen Büchern „caloric restriction mimetic“.
5. Insulinresistenzen sind schlecht. Egal, ob physiologisch oder pathologisch. In beiden Fällen wirkt Insulin nicht mehr. Das aber wird für viele wichtige physiologische Prozesse gebraucht. Alles, was mit Anabolismus zu tun hat, wird auch über die Insulin/IGF-Achse reguliert, selbst das nächtliche Wachstumshormon wirkt partiell über diese Achse. Stammzell-Mobilisation, Wachstum und Proliferation, genau wie Aufrechterhaltung wichtiger mitochondrialer Signalwege (PGC-1alpha), bedarf einer guten Insulinwirkung.
6. Nicht Fett an sich ist schlecht für die Insulinsensitivität. In unzähligen Studien wurde gezeigt, dass speziell die Ölsäure und mehrfach ungesättigte Fettsäuren wie DHA/EPA sogar sehr förderlich wirken. Umgekehrt zeigt sich, dass die Hauptkomponente von Milchfetten, Palmitinsäure, zyto- und mitotoxisch wirkt. Die Effekte können aber kompensiert werden durch eine gleichzeitige Anwesenheit von Ölsäure, weshalb Tierfett (ungesättigt:gesättgt = 1:1) förderlicher wirkt als Sahne, Butter und Co.
7. Fett in der Ernährung ist lange kein Problem, sofern die Fette aus den eben genannten Quellen kommen und der Kohlenhydratanteil der Nahrung nicht zu stark absackt, denn dann gibt es eine physiologische IR. Außerdem, solange das Individuum (stoffwechsel-)gesund ist und Blut-Fettsäurekonzentrationen bedarfsgerecht reguliert werden. Außerdem:
8. Die oxidative Kapazität eines Individuums entscheidet weitestgehend darüber, ob jemand (pathologisch) insulinresistent wird oder nicht. Jemand, dessen Muskel über eine ausreichende Mitochondrien-Dichte und die entsprechende Kapazität zur Oxidation von Fettsäuren ( = oxidative Kapazität) verfügt, verträgt ohne Probleme eben mehr Fettsäuren (ohne insulinresistent zu werden) als die moppelige Petra (sorry, Petras), die sich nie bewegt. Sportler, z. B., kompensieren also viel, viel mehr und sind nicht gerade ein Paradebeispiel dafür, wie man sich am besten ernährt. Bedeutet:
9. Die Insulinsensitivität wird von unten nach oben gesteuert. Wenn der Sog in den Zellen stimmt, stimmt auch die Wirkung des Insulins. Gesteuert wird das z. B. via AMP/ATP-Ratio und AMPK-Aktivierung. Wieder ein Grund, warum negative Energiebilanzen wichtig sind und warum jemand, der sich in einem (chronischen) Energieüberschuss hält, nicht insulinsensitiv ist. Kann man auf zellulärer Ebene auch messen.
10. Es gibt viele, viele Faktoren, die da noch mit reinspielen. Beispiele: Der Spurenelement-Haushalt: Mangan, Kupfer, Selen, Chrom, Zink etc. potenzieren alle die Insulin-Wirkung, sind essentiell für die Insulin-Ausschüttung oder regulieren die Rezeptor-Dichte in Zielgeweben. Adipokin-Status reguliert die Insulinsensitivität via Ausschüttung von Adiponectin, Resistin, RBP und Co. – gesteuert wird das wiederum z. B. von Retinsäure (Hormon aus Vitamin A), aber auch Ernährungs-unabhängig. Übergeordnete Schaltstellen wie der NO-Haushalt, der PGC-1alpha reguliert, regulieren den zellulären Energiestoffwechsel. NO-Ausschüttung wird z. B. durch Sonnenlicht getriggert. Zum NO gibt es ein ganzes Büchlein von uns. Auch das Ansprechen von PGC-1alpha an sich ist essentiell. Kann man alles im Energie-Buch oder im Blog nachlesen. Auch der Cholesterin-Anteil der Muskelmembranen spielt eine wichtige Rolle, wobei mittlerweile klar ist, dass ein zu hoher Membran-Cholesterin-Anteil das Glukose-Trafficking blockiert. Cholesterin-Wert von 300 ist somit auch nicht gerade förderlich.
11. Insulinresistenz merkt man leider nicht direkt. 1. weil der Körper sehr gut und sehr lange kompensieren kann. Und 2. weil erst dann der Blutzucker richtig ansteigt, wenn auch die Leber vollfett ist und keine Glukose mehr aufnimmt.
12. Zu guter Letzt: Strikt unterscheiden muss man eine isokalorische ketogene Diät und eine hypokalorische ketogene Diät. Bei der letzteren Version macht der Körper Ketonkörper etc. aus dem eigenen (Körper-)Fett. Letztere Version wird bei metabolisch Kranken die Stoffwechselgesundheit verbessern, weil sie a) Körperfett verbrennen (was an sich problematisch ist, s. o.) und b) keine Kohlenhydrate mehr essen, was an sich förderlich ist, wenn man keine mehr verträgt …
—-
Damit ist vieles gesagt. Unterm Strich bleibt (erkennbar zwischen den Zeilen): Insulinresistenz (und Folgen) wird nicht umsonst als „Wohlstandserkrankung“ bezeichnet. Wäre für den Großteil von uns kein Problem, würden wir normal leben. Und das wiederum hat weniger mit einer bestimmten Ernährung zu tun als viel mehr mit Stressoren, denen wir uns heute nicht mehr aussetzen. Sport, Kälte, Fasten, Kalorienrestriktion, unverarbeitete Lebensmittel, Hitze … Pain, motherfucker!
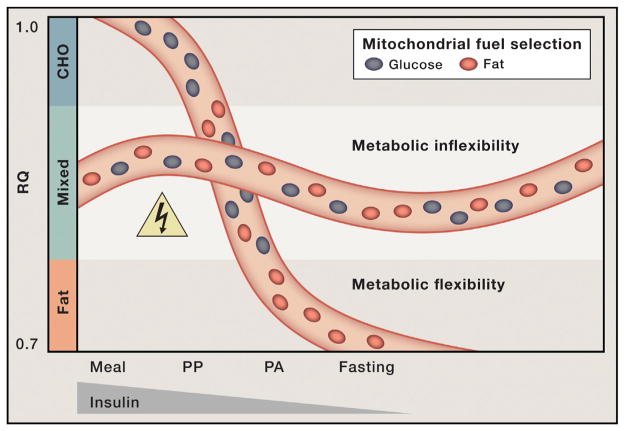
Insulinresistenz sorgt letztlich dafür, dass wir „metabolisch inflexibel“ werden. Heißt konkret: Wenn wir Kohlenhydrate essen, „switchen“ wir nicht mehr auf Kohlenhydrat-Oxidation. Gleichzeitig sind wir auch tierisch schlecht darin, Fettsäuren zu oxidieren, wenn’s drauf ankommt. Zum Beispiel über Nacht oder zwischen Mahlzeiten. Das lässt sich grafisch darstellen:

3 comments On In 12 Punkten Insulinresistenz verstehen
Hallo Isabella,
interessant, was du festgestellt hast. So wie ich es seitens meiner Endokrinologen gehört habe, sorgt das Progesteron dafür, dass die übermäßige Insulinausschüttung verringert wird. Ist P. niedrig, ist das Östrogen (fettbildend) relativ gesehen im Überschuss. Progesteron ist ein sehr beliebtes Hormon, da es die Stimmung hebt und für die Schilddrüsenhormone wichtig sind. Beide interagieren miteinander.
Die Ursache von PMS und Heißhungerattacken soll, wie ich gelesen habe, u.A. In einem niedrigen Progesteronspiegel liegen.
Mich würde die Meinung zu diesem Thema ebenfalls brennend interessieren. LG C.
Hallo Chris
Bei mir wurde vor ca. 3 Jahren eine Insulinesistenz diagnostiziert. Ich habe seitdem meine Ernährung umgestellt ( ich ernähre mich nicht Low Carb!, keine Süßigkeiten, nur Wasser als Getränk, koche nur frisch, etc.). Ich habe mittlerweile 17kg abgenommen und bin jetzt normalgwichtig. Die Werte sind zwar etwas besser geworden, haben sich aber trotzdem nicht normalisiert. Ich konnte mir damals einfach nicht erklären warum!! Als ich letztes Jahr schwanger geworden bin musste ich Progesteron nehmen und siehe da meine Werte haben sich schlagartig verbessert. Als ich dann ca. 5 Wochen kein Progesteron genommen habe, waren die Werte wieder schlechter. Nach erneuter Einnahme sind sie wieder besser geworden. Nach der Geburt sind die Werte wieder mit und mit schlechter geworden. Ich kontrolliere täglich meinen Blutzucker,deshalb sehe auch direkt irgendwelche Veränderungen. Habe meinen Arzt darauf angesprochen, er meinte da gebe es keinen Zusammenhang??? Da ich immer noch stille, kann ich keine Experimente starten. Hast du evtl. eine Idee, wo bei mir das Problem sein könnte?
Lg Isabella
Die Frage von Isabella würde mich auch interessieren.
Wie siehst du da den Zusammenhang Chris? Oder siehst du überhaupt einen?
Gruß Warona