Zugegeben: Die Überschrift ist etwas unpräzise.
Denn es geht in diesem Post nicht um den „Johannes“ (Penis), sondern viel mehr um die Fertilität, die aus gesunden Hoden resultiert – um dem Kind einen Namen zu geben: Testosteron.
Along these lines, there is no example yet of a molecule being a hormone in the mouse that has abruptly lost this attribute in humans. This is, nevertheless, an aspect of osteocalcin that will need further investigation in the future.
Der letzte Satz ist sehr entscheidend, auch im Hinblick auf unsere Arbeit. Hier steht, dass es kein Beispiel für ein Hormon gibt, das hormonelle Wirkung in der Maus, nicht aber im Menschen hat.
Die Autoren nennen sogleich ein solches Hormon: Osteocalcin.
Mittlerweile wissen wir, dass jedes Gewebe, sei es der Muskel, das Fettgewebe, das Herz et cetera, selbst Botenstoffe sekretieren kann, um mit anderen Geweben zu kommunizieren.
Vitamin K macht Osteocalcin „scharf“
Die klassische Lehre, auch in der Endokrinologie, fokussiert nach wie vor klassische Hormone – Testosteron, DHEA und so weiter.
Zeitgleich überhäuft uns die Wissenschaft mit bis dato recht unbekannten Hormonen und deren Wirkung(en).
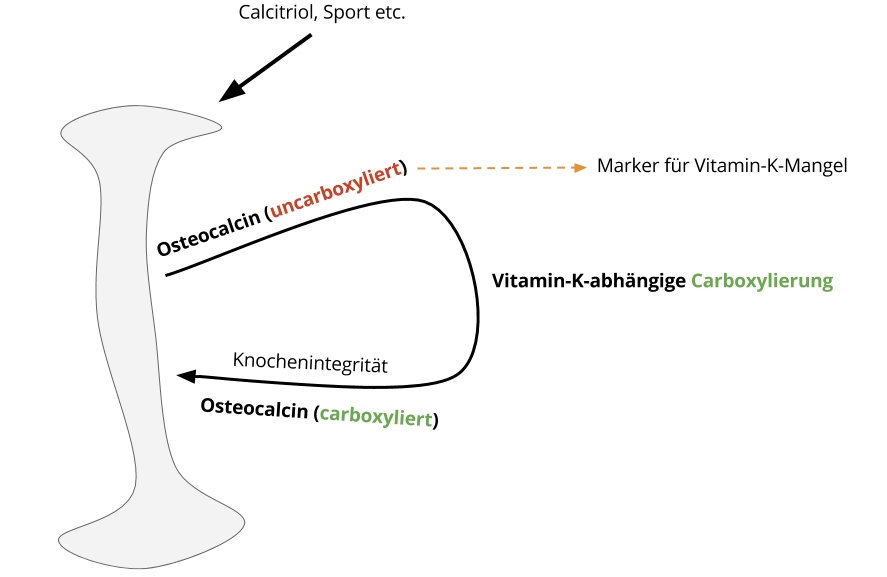
Osteocalcin ist ein solcher Botenstoff. Es wird vom Knochen (genauer: von den integritätsfördernden Osteoblasten) sekretiert, bei Menschen hauptsächlich stimuliert durch das aktive Vitamin D namens Calcitriol. Allerdings spekuliere ich, dass alle Situationen, die einen Knochenaufbau stimulieren, zu einer Ausschüttung von Osteocalcin führen – so vermag auch Sport die Osteocalcin-Ausschüttung anzuregen. Normalerweise erfolgt diese Ausschüttung in seiner „uncarboxylierten“ Form. Vitamin K wiederum carboxyliert Osteocalcin, was dann die Knochenintegrität (sprich: Knochengesundheit) fördert. Drum ist das carboxylierte Osteocalcin ein Marker für den Vitamin-K-Status, der nahezu auf täglicher Basis (stark) fluktuieren kann und wenige Tage ausreichen, um eine akute Defizienzsituation herbeizuführen.
Wie der Knochen den Stoffwechsel reguliert
Bekannt wurde Osteocalcin aufgrund von KO-Mäusen, die dieses Hormon nicht mehr bilden konnten.
Diese Mäuse waren direkt dick, insulinresistent und hatten, so würden wir Pfälzer sagen, schlechte Knochen. Umgekehrt sind Mäuse mit hohen Osteocalcin-Werten resistent gegen metabolische Entgleisungen, sprich Insulin-Resistenz, Fettleibigkeit und Co.
Man fand heraus, dass Osteocalcin auf die ß-Zellen der Bauchspeicheldrüsen wirkt, den Energieumsatz erhöht und darüber hinaus die Ausschüttung des Fettgewebe-spezifischen Adipokins namens Adiponektin stimuliert. Dieses wiederum fördert ebenfalls die ß-Zell-Gesundheit und erhöht im Zielgewebe die Insulinsensitivität.
Insgesamt also scheint Osteocalcin sehr deutlich den Glukose-Stoffwechsel zu modulieren, was zumindest in Mäusen zu weniger Fettakkumulation führt. Dies kann man sich freilich dadurch erklären, dass Nagetiere sehr viel aktiver Fett aus Glukose in Fettzellen synthetisieren als Menschen und eine Glukose-Partitionierung hin zum Muskel einen Fettverlust herbeiführt – beim Menschen vermutlich nicht derart ausgeprägt (meine Vermutung).
Osteocalcin macht potent: Der Knochen steuert die Big-T-Produktion
2011 wurde eine beeindruckende Arbeit veröffentlicht, die ganz, ganz aufwendig zeigte, dass das uncarboxylierte Osteocalcin direkt auf die Leydig-Zellen des Hodens einwirkt und dort ganz dramatisch nicht nur für die Gesundheit der Leydig-Zellen verantwortlich ist, sondern auch massivst die Testosteron-Produktion reguliert. Nager, die Osteocalcin nicht bilden konnten (Osteocalcin-KO) hatten deutlich niedrigere Testosteron-Werte. Zeitgleich wurde gezeigt, dass Osteocalcin so die Fertilität der Nager modifiziert.
Wenngleich Osteocalcin keinen Einfluss auf die Östrogen-Produktion an sich hatte, wurde gezeigt, dass Osteocalcin-KO-Tiere neben den niedrigeren Testosteron-Werten auch höhere Östrogen-Werte aufwiesen. Der Grund hierfür ist, so spekulieren die Autoren, dass Osteocalcin-KO-Tiere eine höhere Fettmasse zeigten, die bekanntermaßen Androgene zu Östrogenen aromatisiert. Im Grunde: Doppelt blöd.
Uncarboxyliert oder carboxyliert? Beim Menschen noch unklar
Nun, so bahnbrechend und erhellend diese Studien auch sind … Sie werfen auch Fragen auf: Beim Menschen gibt es keine klare Evidenz dafür, dass das uncarboxylierte Osteocalcin so wirkt wie in diesen Tieren, wenngleich auch wir über die gleichen Rezeptoren verfügen. Sollte nur das uncarboxylierte Osteocalcin eine Rolle spielen, wäre Vitamin K eher schädlich als förderlich – zumindest im Hinblick auf die hier genannten Benefits.
Tatsächlich weisen einige Forschungen darauf hin, dass im Menschen nicht so sehr das uncarboxylierte Osteocalcin die Hauptrolle spielt, sondern das carboxylierte, heißt das Vitamin-K-aktivierte Osteocalcin. Der Grund ist simpel: Die Zufuhr von Vitamin K senkt nicht die Insulinsensitivität, sondern verbessert sie.
We conclude that unlike in rodents, cOC (Anm.: carboxyliertes Osteocalcin) rather than ucOC (Anm.: uncarboxyliertes Osteocalcin) may be the endocrine hormone that increases insulin sensitivity in humans.
Hier steht noch einiges an Forschungsarbeit an.
Was wir allerdings sagen können: „Schlechte Knochen“ verschlechtern ganz offensichtlich das hormonelle Milieu des Körpers. Wir wussten, dass ein Abfall von Testosteron die Knochengesundheit negativ beeinflusst, doch nun scheint es zusätzlich so zu sein, dass die schlechte Knochengesundheit im Umkehrschluss dieses anabole Milieu (in Form von Testosteron) weiter verschlechtert.
Nun … Jetzt kenne ich viele, viele Blutwerte. Und ganz offen gesagt … Das bringt mich ein wenig zum Grübeln.
Vielleicht haben wir Männer kein Problem mit dem Kopf, der Nebenniere oder dem Hoden, sondern mit dem Knochen. Wer weiß?
In 10 Jahren sagen wir dann: Wie der Knochen des Mannes, so sein Johannes :-)
Literatur
Choi, H. J.; Yu, J.; Choi, H. u. a. (2011): „Vitamin K2 Supplementation Improves Insulin Sensitivity via Osteocalcin Metabolism: A Placebo-Controlled Trial“. In: Diabetes Care. 34 (9), S. e147-e147, DOI: 10.2337/dc11-0551.
Clarke, B.L. (2011): „Endocrine Regulation of Male Fertility by the Skeleton“. In: Yearbook of Endocrinology. 2011 , S. 217-218, DOI: 10.1016/j.yend.2011.04.024.
Coiro, V.; Volpi, R.; Cataldo, S. u. a. (2012): „Effect of physiological exercise on osteocalcin levels in subjects with adrenal incidentaloma“. In: Journal of Endocrinological Investigation. 35 (4), S. 357-358, DOI: 10.1007/bf03345430.
Gundberg, C. M.; Lian, J. B.; Booth, S. L. (2012): „Vitamin K-Dependent Carboxylation of Osteocalcin: Friend or Foe?“. In: Advances in Nutrition: An International Review Journal. 3 (2), S. 149-157, DOI: 10.3945/an.112.001834.
Kim, Yu-Sik; Nam, Ji Sun; Yeo, Dong-Wook u. a. (2014): „The effects of aerobic exercise training on serum osteocalcin, adipocytokines and insulin resistance on obese young males“. In: Clin Endocrinol. 82 (5), S. 686-694, DOI: 10.1111/cen.12601.
Levinger, I.; Zebaze, R.; Jerums, G. u. a. (2010): „The effect of acute exercise on undercarboxylated osteocalcin in obese men“. In: Osteoporosis International. 22 (5), S. 1621-1626, DOI: 10.1007/s00198-010-1370-7.
Patti, Aurora; Gennari, Luigi; Merlotti, Daniela u. a. (2013): „Endocrine Actions of Osteocalcin“. In: International Journal of Endocrinology. 2013 , S. 1-10, DOI: 10.1155/2013/846480.

1 comments On Wie der Knochen eines Mannes, so sein Johannes – Osteocalcin & Testosteron
Hallo Chris,
weisst Du, ob in fermentiertem Gemüse auch K2 ist? Ich denke da an Rote Bete Saft milchsauer vergoren. Das wären dann wieder viele Fliegen mit einer Klappe. Hab dazu bisher nix gefunden.