Was ist eine Muskelfaser? Welche Muskelfasern gibt es? Welche Rolle spielen sie in unserem sportlichen Dasein? Wie können wir sie verändern? Und was hat der Glukose-Transport bzw. die Insulin-Sensitivität damit zu tun?
Alles das sind Fragen, die ich dir heute, mit Hilfe dieses Artikels, gerne erklären möchte.
Das Muskelfaser-1×1
Jeder von uns hat schon den Begriff „Muskelfaser“ gehört. Im Prinzip sind Muskelfasern mehrkernige Zellen. Wir könnten vereinfacht zusammenfassen: Vorläufer-Muskelzellen, die sogenannten Myoblasten (auch Satellitenzellen genannt), verschmelzen miteinander zu einer Muskelzelle – dies passiert in aller Regel schon in der Embryonalphase, wenngleich die Fähigkeit zur Neubildung von Muskelzellen (= Muskelfasern) durchaus zeitlebens erhalten bleibt (übrigens ist das ein sehr umstrittenes Thema in der Physiologie: Gibt es „Hyperplasie“ (= Muskelwachstum durch Neubildung von Muskelzellen) oder wächst der Muskel nur durch Hypertropie?). Charakteristisch hierfür ist die länge der Zelle und auch die Tatsache, dass die Zelle mehrkernig ist im Vergleich zu einkernigen Zellen, die man normalerweise findet.

Muskelfasern werden organisiert, so dass mehrere Muskelfasern zusammenlagern, umgeben von einer Membran. Dies nennt man Muskelfaserbündel. Der Muskel als Ganzes besteht aus mehreren Muskelfaserbündeln.
Generell kann man mehrere Arten von Muskelfasern vorfinden, gegliedert in „Typ 1“ und „Typ 2“.
- Typ-1-Fasern zeichnen sich durch extremes Mitochondrienreichtum aus, sind sehr kapillarisiert (= viele Blutgefäße), haben sehr viel Sauerstoffspeicher vor Ort, genannt Myoglobin und – ganz wichtig – nutzen Fettsäure als Hauptenergiequelle (= oxidativer Stoffwechsel). Daher lagern diese Muskelzellen auch mehr Triglyceride (= 3 zusammengebaute Fettsäuren) als Speicherform ein. Wichtig: Die kontraktile Eigenschaft ist so ausgelegt, dass die Muskelfaser zwar wenig Kraft generieren kann, das aber über einen sehr langen Zeitraum.
Typ-2-Fasern können weiter untergliedert werden:
- Typ-2A-Fasern verfügen ebenfalls über eine hohe mitochondriale Dichte, sind ebenfalls recht stark kapillarisiert, weisen auch einen hohen Myoglobin-Gehalt auf, nutzen aber sehr häufig Kohlenhydrate als Energiequelle, was einhergeht mit mehr Glykogen als Speicherform (wenngleich wir auch hier eingelagerte Triglyceride finden). Diese Muskelfaser kann mehr Kraft entwickeln und das auch über einen recht beachtlichen Zeitraum. Dieser Muskelfaser-Typ ist also kräftig und ausdauernd.
- Typ-2X-Fasern weisen im Vergleich zu den vorherigen Faser-Typen einen sehr wenig ausgeprägten oxidativen Stoffwechsel auf, heißt: Hier finden wir sehr wenig Mitochondrien, die Muskelfaser ist weniger kapillarisiert, wir finden weniger Myoglobin, was letztendlich dafür sorgt, dass die Faser unter dem Mikroskop weiß aussieht, nicht rot. Der Vorteil dieser Faser ist, dass sie sehr kräftig ist. Aber die Faser ermüdet auch dementsprechend schnell, denn diese Faser gewinnt ihre Energie „anaerob“. Das bedeutet, dass die Energie mit Hilfe von Glukose gewonnen wird, aber nicht über den oxidativen Stoffwechsel (= Mitochondrien), sondern unvollständig zu Laktat (Anion der Milchsäure).
Wir müssen unbedingt beachten, dass es diverse Zwischenstufen gibt und die Faserbestimmung in aller Regel nicht so eindeutig ist wie hier dargestellt.
Dies impliziert, dass Muskelfasern-Typen auch „konvertieren“ können und andere molekulare und kontraktile Eigenschaften übernehmen können. In der Tat ist genau diese Eigenschaft etwas, was das hoch plastische Organ ausmacht: Der Muskelfasertypus kann „switchen“.
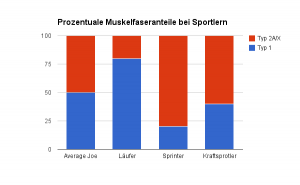
Markant ist, dass jede Art von Training normalerweise dafür sorgt, dass der prozentuale Anteil von Typ-2X-Fasern abnimmt, während der prozentuale Anteil von Typ-1/2A-Fasern zunimmt. Dies ist jedoch – und logischerweise – abhängig von der Trainingsart (Ausdauersport vs. Krafttraining etc.).
Generell können wir davon ausgehen, dass jede Muskelfaser auf einen Trainingsreiz reagiert, und zwar Trainingsart-spezifisch. Das heißt, dass Krafttraining dafür sorgen wird, dass auch Typ-1-Fasern hypertrophieren. Das heißt außerdem, dass Ausdauertraining dafür sorgen wird, dass auch Typ-2-Fasern an Eigenschaften gewinnen, die eine gesteigerte Ausdauerleistungsfähigkeit ermöglichen (Widrick, 2002).
Die gerade beschriebenen Prozesse sehen wir vor allem zu Beginn eines jeweiligen Trainings. Die Muskelfaser beginnt sich (als Beispiel) auf kontraktiler Ebene (z. B. MHC- und Troponin-Isoformen) und auf biochemischer Ebene (oxidativer vs. glykolytischer Stoffwechsel, d. h. mehr/weniger Mitochondrien, mehr/weniger Fettsäuren-Oxidation, mehr/weniger Kohlenhydrat-Oxidation etc.) zu verändern (Baumann, 1987 | Widrick, 2002).
Wie profund solche Veränderungen sein können, das können wir beobachten, wenn wir den Muskel oder eine Muskelfaser elektrisch stimulieren und somit quasi ein jeweiliges Training (schnelle vs. langsame Kontraktion) „mimen“: Bei chronischer Niedrigfrequenz-Stimulation ändern sich sowohl die kontraktilen Eigenschaften (MHC-Isoform), als auch die biochemischen Eigenschaften. Das bedeutet, dass sich eine Typ-1-Faser wandeln kann hin zu einer Typ-2-Faser und umgekehrt (Zhang, 2005) .
Dies hat weitreichende Folgen, denn das bedeutet, dass du auch die Eigenschaften deiner Muskelfasern selbst in der Hand hast.
Auch in vivo, das heißt im Menschen, können wir eine derartige Veränderung beobachten: Hochtrainierte Radfahrer verfügen fast ausschließlich über Typ-1-Fasern (80 %). Natürlich könnte man argumentieren, dass sie deshalb „hochtrainierte Radfahrer“ wurden, weil sie von Natur aus einen derart hohen Prozentsatz an Typ-1-Fasern mitbringen, allerdings weisen diverse Untersuchungen darauf hin, dass dies nicht der Fall ist bzw. beide Szenarien möglich wären und sind (Baumann, 1987).

Die Muskelfaser-Switch-Biochemie
Wenn wir ergründen wollen, woran ein Muskel erkennt, dass er sich wandeln, sich anpassen soll, dann müssen wir uns natürlich fragen was auf molekularer Ebene passiert.
Ausdauertraining auf zellulärer Ebene
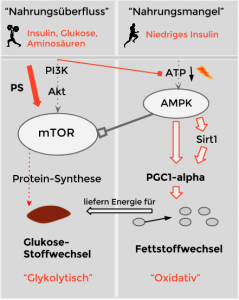
Die erste und grundlegende Beobachtung ist die folgende: Ausdauersport sorgt dafür, dass vermehrt AMPK aktiviert wird, wohingegen Krafttraining dafür sorgen wird, dass vermehrt mTOR aktiv wird. (Anmerkung: Diese zwei „Schalter“ bilden das zentrale Thema meines Buches und ich verweise an dieser Stelle auf die Inhalte des Buches.)
Im Prinzip sind AMPK und mTOR zelluläre Master-Regulatoren, die der Zelle ermöglichen adäquat auf Umweltereignisse zu reagieren.
Man erkannte schon früh, dass AMPK verantwortlich ist für Ausdauer-spezifische Anpassungen (Lantier, 2014). Doch, wie wir alle wissen, ist es nicht AMPK selbst, das für die Anpassungen sorgt, sondern das Protein, das von AMPK aktiviert wird: PGC1-alpha. In der Tat wurde gezeigt, dass PGC1-alpha direkt die Anpassung von Ausdauer-spezifischen Eigenschaften mediiert.
Das macht auch Sinn: Wenn wir uns kurz daran erinnern, dass PGC1-alpha der Hauptregulator der mitochondrialen Dichte ist, dann leuchtet die große Rolle von PGC1-alpha direkt ein, denn ohne Mitochondrien … gibt es auch keine Ausdauer („oxidative Kapazität“).
Wir können dies testen anhand von mehreren Szenarien. Wir könnten Tierchen laufen lassen (= Sport machen) und beobachten was passiert … oder: Wir züchten Tierchen, die über mehr („over-expression“) oder weniger („knock out“) PGC1-alpha verfügen.
Kurz: Mehr PGC1-alpha sorgt dafür, dass die Faser einen Switch herbeiführt in Richtung Typ-1 (Lin, 2002). Weniger PGC1-alpha sorgt dafür, dass die Muskelfaser weniger (= keine) Ausdauer-spezifische Adaptationen vorweist, dafür aber aussieht wie eine Typ-2-Faser (Handschin, 2007).

Krafttraining auf zellulärer Ebene
Krafttraining sorgt dafür, dass vermehrt mTOR aktiv wird. MTOR reguliert die Protein-Synthese in den Zellen und somit natürlich auch die Protein-Synthese des Ortes, wo wir Protein am meisten brauchen: Im Muskel (Vgl. Michalk, 2014).
Wie mehrfach beschrieben nennt man den diesen PI3K/Akt/mTOR-Signalweg auch „anabolen Signalweg“. Dies liegt ganz einfach daran, dass die Zelle über diesen Signalweg den zelleigenen Anabolismus steuert. Dieser Signalweg wird aktiviert durch mechanische Stimulation – daher können wir eine erhöhte Aktivität des mTOR-Signalwegs nach Kraftsporteinheiten feststellen (Joy, 2014). Als erste deutsche Quelle habe ich dir hingeschrieben warum dies der Fall ist: Die Zelle reguliert diese – durch Krafttraining induzierte – mTOR-Aktivität – mit Hilfe von Phosphatidsäure.
Doch auch Insulin und Aminosäuren (= Protein) aktivieren diesen Signalweg.
Beeindruckend: Züchtet man Mäuse, die mehr Akt produzieren und somit auch mehr mTOR-Aktivität zeigen, dann verfügen diese Mäuse über dramatisch mehr Muskulatur, mehr Kraft und erstaunlicherweise auch deutlich weniger Körperfett.
Dieser Signalweg sorgt nämlich nicht nur dafür, dass ein bestimmter Muskelfaser-Typ (Typ-2-Faser) vermehrt wächst, sondern auch dafür, dass entsprechend der Zucker-Stoffwechsel im Muskel verbessert wird.
Diese Mäuse haben daher eine deutlich verbesserten Glukose-Toleranz, dadurch auch eine deutlich bessere Insulin-Sensitivität. Die verringerte Fettmasse kann man durch zwei Szenarien erklären: Zum wird im Fettgewebe von Nagetieren deutlich mehr Fettneubildung (aus Kohlenhydraten) betrieben. Eine bessere muskuläre Insulin-Sensitivität würde bedeuten, dass weniger Substrat zur Verfügung stehen würde, um daraus Fett zu synthetisieren.
Ein anderes Szenario, postuliert von den Autoren, besagt, dass der Fettstoffwechsel der Leber verbessert war. Diese Veränderungen sorgten u. a. dafür, dass die Tiere geschützt waren vor metabolischer Dysfunktion im Alter. (Vgl. Akasaki, 2013)
Ob dies vergleichbar ist mit einer dramatischen Erhöhung der oxidativen Kapazität (quasi als das andere Ende des Spektrums), das kann man derzeit aufgrund der schlechten Datenlage nicht sagen.
Dass der Akt/mTOR-Signalweg involviert ist im Prozess der „slow-to-fast“-Transformation, weiß man auch deshalb, da ß-Adrenoagonisten (z. B. Adrenalin), aber auch Schilddrüsenhormone über diesen Signalweg für einen Faserswitch sorgen. (Vgl. Marini, 2010)
Ganz egal: Diese Studien zeigen, wo und wie muskuläre Eigenschaften entstehen.
Einschub: Real-Life-Implikationen
Bisher habe ich mich sehr fokussiert auf den mitochondrialen Stoffwechsel, wenngleich mir Muskelmasse auch immer sehr wichtig war, weshalb ich versucht habe, einen geeigneten Mittelweg zu finden. Das zeigt sich auch anhand meiner Empfehlungen, sowohl den Fett- als auch den Kohlenhydratstoffwechsel phasenweise und intermittierend zu beanspruchen bzw. zu trainieren.
Im Sinne einer differenzierten Darstellung wollte ich bisher (z. B. im Buch) beide Signalwege erklären und Implikationen erläutern.
Nach wie vor bin ich der Meinung, dass gesunde Mitochondrien die Hauptrolle spielen werden, dann, wenn wir gesund alt werden möchten.
Nur auch hier müssen wir differenzierter werden: Könnten wir einen Muskel haben, der groß ist und wenige Mitochondrien aufweist, aber gleichzeitig über eine Leber, ein Gehirn verfügen, die voll sind mit gesunden Mitochondrien? Das bedeutet, dass wir uns fragen müssen, ob „Gesundheit“ Gewebe-spezifische Unterschiede aufweist.
Denn offensichtlich kann uns auch ein großer, wenig oxidativer Muskel vor metabolischer Dysfunktion schützen. Doch kann er uns auch beim Altern unterstützen? Stichwort Myokine, Irisin etc.
Das bleibt sicherlich abzuwarten, aber wir können heute, 2015, festhalten, dass beide Signalwege sehr wichtig sind bezüglich der Prävention von Krankheiten. Sowohl der mTOR-Signalweg, um große, kräftige und glukosetolerante Muskeln zu generieren, aber auch der AMPK/PGC1-alpha-Signalweg, um für eine entsprechende mitochondriale Gesundheit zu sorgen.
Das Schöne ist, dass wir kein Schwarz/weiß-Denken praktizieren müssen … Stattdessen könnten wir die Muskelfaserkomposition nach Belieben verändern und uns entlang eines Spektrums bewegen und zwar so, wie wir das wollen.
Biohacking: Inositol als „Akt-activating agent“
Wir von edubily kümmern uns um eine Frage: Wie kann ich mir Zustand XY selbst machen und das, wenn möglich, präzise und „schlau“.
Wir konnten sehen, dass Tiere, die mehr Akt im Muskel haben, mehr Muskeln bekommen, kräftiger werden und Zucker besser verarbeiten können … nicht durch mehr Training, sondern durch biochemische/genetische Spielerei.
Das habe ich damals anhand von Phosphatidsäure (PS) gezeigt. Damals lautete die Devise: Man kann trainieren oder man kann trainieren.
Erst vor kurzem habe ich beschrieben, dass und wie Inositol die Insulin-Sensitivität deutlich verbessert. Ich habe mich natürlich gefragt, wie das sein kann und was genau da passiert.
Auch wenn man generell wenig Arbeiten zu diesem Thema finden kann, so bestätigen sich meine Gedanken und Ideen anhand einer – leider nur – Mäuse-Studie.
Inositol verstärkt die Wirkung von Insulin und wirkt selbst Akt-aktivierend. Und zwar so, dass Inositol selbst Akt so stark stimuliert (unter basalen Bedingungen) wie Insulin. Zusammen mit Insulin wird Akt 66 % mehr aktiviert im Vergleich zur Insulin-basierten Stimulation von Akt (Kontrolle). (Vgl. Croze, 2013)
Bitte bedenken: Akt-Aktivierung sorgt für Glukose-Transport in die Zellen. Dies wäre eine sehr einleuchtende Erklärung für die deutliche Verbesserung der Insulin-Resistenz (- 75 % HOMA-Index) in vivo, im Menschen.
Das bedeutet: 5 – 10 g Inositol, ein völlig harmloser, in den Zellen vorkommender (mehrwertiger) Alkohol, früher „Muskelzucker“ (da ähnliche Summenformel wie Glukose etc.) genannt, kann dafür sorgen, dass wir mehr Akt im Muskel haben können. Natürlich handelt es sich dabei nur um Gedanken, um Spielereien, aber wir hätten gerne Optionen und Möglichkeiten.
„Anabolic set point“-Hypothese
… ist ein Gedanke von mir und Phänomen, das ich an mir beobachten konnte.
Bleiben wir bei den oben angeführten Gedanken, so sollte eine chronische Aktivierung von AMPK dafür sorgen, dass eine Typ-1-Faser entsteht oder Fasern, die sich sehr ähnlich verhalten.
Erst neulich habe ich eine Studie via facebook gezeigt, bei der ein klassisches Power-Law-Verhältnis gezeigt wird zwischen VO2max (= oxidative Kapazität) und Muskelfaserdicke. Kurz: Ein dicker Bodybuilder-Muskel mit der Ausdauerleistungsfähigkeit eines Haile Gebrselassie wird schlicht nicht beobachtet – zumindest bei uns Menschen. Bei den Gnus sieht es, wie mehrfach beschrieben, etwas anders aus.
Natürlich wird man dies deshalb nur selten beobachten, weil Menschen etwas dafür tun müssten, so einen Muskel zu bekommen (und diverse biochemische Signalwege selbst modulieren), während Gnus – genetisch betrachtet – quasi dafür prädestiniert sind.
Wenn AMPK für einen Faserswitch in Richtung Typ-1-Faser sorgt und wir gleichzeitig daran denken, dass AMPK biochemisch gesprochen für Katabolismus (= Abbau) steht, dann wird klar …
… warum meine Muskeln im Laufe von 4 Jahren Dauerdiät quasi immer kleiner wurden, dafür aber immer leistungsfähiger (im Vgl. zu vorher).
Umgekehrt konnte ich mit diesen Muskeln den ganzen Tag durch die Gegend sprinten, im hoch anaeroben Bereich, musste aber irgendwann trotzdem keine Kohlenhydrat-Refeeds mehr machen. Genauer gesagt: der Muskel hatte kein Verlangen mehr danach.
Warum auch? Er musste deutlich weniger Masse halten (via PI3K/Akt/mTOR-Signalweg) und konnte gleichzeitig deutlich mehr Fettsäuren verbrennen.
Heute (mit 20 kg mehr Magermasse) sieht das etwas anders aus: Mittlerweile braucht mein Körper, die Muskeln, deutlich öfter „anabolen Input“, also Nahrung, Protein, Insulin etc.
Das ist ein sehr schönes Beispiel dafür, wie man das System moduliert und es sich danach selbst erhält, um einen gewissen Setpoint zu wahren und zeigt plastisch genau das, was wir im Verlauf besprochen haben.
Heißt: Ist das „Muskelschrumpfen“ während einer Diät tatsächlich ein Proteinabbau oder … auch eine metabolische Umstrukturierung in Richtung „Typ-1-Faser“? Wahrscheinlich beides.
Aber eine Sache ist sehr gewiss: Die gesundheitlichen Vorteile einer Kalorienrestriktion (chronisch) entstehen genau über diesen Mechanismus.
Referenzen
Akasaki, Yuichi; Ouchi, Noriyuki; Izumiya, Yasuhiro u. a. (2013): „Glycolytic fast-twitch muscle fiber restoration counters adverse age-related changes in body composition and metabolism“. In:Aging Cell. 13 (1), S. 80-91, DOI: 10.1111/acel.12153.
Baumann, Hugo et al. „Exercise training induces transitions of myosin isoform subunits within histochemically typed human muscle fibres.“ Pflügers Archiv 409.4-5 (1987): 349-360.
Croze, Marine L.; Vella, Roxane E.; Pillon, Nicolas J. u. a. (2013): „Chronic treatment with myo-inositol reduces white adipose tissue accretion and improves insulin sensitivity in female mice“. In: The Journal of Nutritional Biochemistry. 24 (2), S. 457-466, DOI: 10.1016/j.jnutbio.2012.01.008.
Handschin, C.; Chin, S.; Li, P. u. a. (2007): „Skeletal Muscle Fiber-type Switching, Exercise Intolerance, and Myopathy in PGC-1 Muscle-specific Knock-out Animals“. In: Journal of Biological Chemistry. 282 (41), S. 30014-30021, DOI: 10.1074/jbc.m704817200.
Joy, Jordan M; Gundermann, David M; Lowery, Ryan P u. a. (2014): „Phosphatidic acid enhances mTOR signaling and resistance exercise induced hypertrophy“. In: Nutr Metab (Lond). 11 (1), S. 29, DOI: 10.1186/1743-7075-11-29.
Lantier, L.; Fentz, J.; Mounier, R. u. a. (2014): „AMPK controls exercise endurance, mitochondrial oxidative capacity, and skeletal muscle integrity“. In: The FASEB Journal. 28 (7), S. 3211-3224, DOI: 10.1096/fj.14-250449.
Lin, Jiandie; Wu, Hai; Tarr, Paul T. u. a. (2002): „Transcriptional co-activator PGC-1α drives the formation of slow-twitch muscle fibres“. In: Nature. 418 (6899), S. 797-801, DOI: 10.1038/nature00904.
Marini, Marina; Veicsteinas, Arsenio (2010): „The exercised skeletal muscle: a review“. In:European Journal of Translational Myology. 20 (3), S. 105, DOI: 10.4081/bam.2010.3.105.
Michalk, Chris; Böhm, Phil (2014): Das Handbuch zu Ihrem Körper. Leipzig: CreateSpace.
Widrick, Jeffrey J et al. „Functional properties of human muscle fibers after short-term resistance exercise training.“ American Journal of Physiology-Regulatory, Integrative and Comparative Physiology 283.2 (2002): R408-R416.
Zhang, SY et al. „[Adaptation of myofibrilla, MHC and metabolic enzyme of rabbit diaphragm muscle to different frequency chronic electrical stimulation].“ Zhongguo ying yong sheng li xue za zhi= Zhongguo yingyong shenglixue zazhi= Chinese journal of applied physiology 21.4 (2005): 367-370.

4 comments On Was die Muskelfaser für deine Gesundheit tun kann
Hi Chris,
ja, auch für mich ist die Info neu, dass ST zu FT-Fasern umgeswitcht werden können. Die klassische Literatur sieht es, wie so oft, anders. Dort heißt es, dass nur die Typ 2A-Fasern zu Typ 1-Fasern durch entsprechendes Ausdauertraining umfunktioniert werden können, aber niemals umgekehrt; auch nicht Typ 2A in 2X-Fasern.
In diesem Zusammenhang mal eine etwas andere Frage: Was passiert genau bei Maximalkrafttraining? Werden die Myofibrillen „nur“ dicker (mehr parall geschaltete Sarkomere?) und besser vom ZNS angesteuert oder nimmt deren Anzahl auch zu?
Interessantes Thema; vielen Dank im Voraus und beste Grüße
Peter
Hi Peter,
na ja … wie „klassisch“ ist denn die Literatur da? :-)
Eigentlich liest man in jeder Arbeit, die MHC-Isoformen etc. bestimmen, dass Muskelfasern konstant „switchen“. Klar: Wer das zwei Wochen lang untersucht, der wird hier kein eindeutiges Bild erhalten, vielleicht nur „Marker“ (PGC1-alpha/mTOR o. ä.), aber nach 3-4 Monaten sieht man eigentlich immer diese Veränderung der Fasern.
Dass 2A nicht zu 2X werden kann … stimmt auch nicht: Wenn man sich auf die faule Haut legt, dann werden die metabolisch aktiven 2A-Fasern zu den trägen, aber „kräftigen“ 2X-Fasern. Und umgekehrt sind die 2X-Fasern die, die am schnellsten umwandeln in metabolisch aktivere Fasern während Trainingsphasen.
—–
Gute Frage: Ja, die Fasern werden hypertrophieren. Ob Hyperplasie auch für „dickere Muskeln“ sorgt … das weiß man derzeit noch nicht, zumindest nicht beim Menschen. Bei Vögeln, die man mit Gewichten belastet, beobachtet man das und auch sehr markant.
Beim Menschen ist halt auch das Problem … wer zählt die ganzen Fasern? :-) Das ist immer so eine Sache. Machen meistens quasi die „Praktikanten“ des Forscherteams. Und: Stelle dir mal einen Schwarzenegger vor … sollen solche Riesenmuskeln nur durch Hypertrophie entstanden sein? Vernünftige Sportwissenschaftler glauben das nicht.
LG, Chris
Das ist „mein“ Artikel ;-)! Vielen Dank! Besonders interessant für mich war die Information, dass Typ I-Fasern zu Typ II-Fasern umgewandelt werden können. Das war für mich neu. Bekanntlich reagieren ja auf Muskeltraining nur die Typ II-Fasern. Hat man nun die Genetik eines äthiopischen Wunderläufers mit 90% Typ I-Fasern, dann war für mich immer klar, dass dann logischerweise nicht viel geht in Sachen Muskelaufbau. Durch die Möglichkeit der Umwandlung besteht also wieder Hoffnung für alle Hardgainer dieser Welt ;-)…
Wieder ein schöner Artikel.
War mir neu, dass Typ1 auch zu Typ2 werden können. Dachte immer es geht nur in eine Richtung.
Würde es einen großen Effekt haben wenn man sich an Trainingstagen für die Typ1-Fasern (Cardio) AMPK-orientiert ernährt und an Trainingstagen für die Typ2-Fasern (Krafttraining) mTOR-orientiert?
Im Kraftsport gibt es ja Faserspezifisches Training – was hälst du davon Chris?