Für gewöhnlich bekommt die Schilddrüse nur Aufmerksamkeit geschenkt, wenn etwas nicht stimmt. Ein Kropf, Über-und Unterfunktionen oder Autoimmunerkrankungen.
Über solche Fälle habe ich in Teil II geschrieben.
Ist mit der Schilddrüse aber alles in Ordnung, freut man sich und denkt nicht großartig weiter darüber nach. Sie macht einfach konstant ihre Arbeit – oder etwa nicht?
In den typischen Abhandlungen über die Schilddrüse wird wenig über deren dynamische Regulation geschrieben. Während heutzutage jeder Insulin und Cortisol als fluktuierende Hormone kennt, wird sich die Schilddrüse als eine Art “Sanduhr” vorgestellt. Beständig lässt sie eine immer gleichbleibende Menge an “Sandkörnern heraus rieseln”.
Die Vorstellung eines solchen steady state trifft wohl nicht wirklich zu. Gerade im Zeitalter des Fitnesskults kann man die “dynamische Schilddrüse” besonders häufig beobachten. Leider.
Man muss nur genau hinsehen:
Viele sind dauerhaft und radikal am Diäten, betreiben langes Fasten für die Langlebigkeit und unterwerfen sich einem überzogenen Sportpensum. Ach, und Kohlenhydrate sind seit dem Paleo-Hype ja sowieso die Wurzel allen Übels.
In Foren-Deutsch wird den Betroffen das Resultat wie folgt mitgeteilt:
“Tja, du hast dir den Stoffwechsel zerschossen!”
Auf edubily findet man natürlich eine ausführlichere Erklärung und Abhilfe ;-)
Wie dein Lifestyle die Schilddrüsen-Achse beeinträchtigen kann
Es sollte nach dem vorausgegangen Teil schon ersichtlich sein, dass die oben aufgezählten Stressoren auf unzähligen Ebenen die Wirkung der Schilddrüsenhormone torpedieren können.
In diesem Teil widme ich mich der Peripherie und warum bei vielen Fitnessjunkies vermutlich eine gestörte Konversion von T4 in T3 vorliegt. Ein besonderes Augenmerk habe ich auf die Bedeutung des Selenstatus für die Deiodierung gelegt und verschiedene Möglichkeiten der Supplementierung diskutiert.
Low-T3-Syndrom: Hohe Relevanz für Menschen mit kritischem Gesundheitszustand
Beobachtungen auf Intensivstationen waren die Inititalzündung für viele der Studien, um die es in diesem Artikel gehen wird. Schwerkranke, Unterernährte oder Fastende (> 72 h) zeigen dramatische Veränderungen in der Schilddrüsenachse. Da man feststellte, dass die jeweiligen Veränderungen Indikatoren für das Überleben darstellen, ist man sehr daran interessiert die beteiligten Mechanismen zu verstehen (1 Ray et al., 2002).
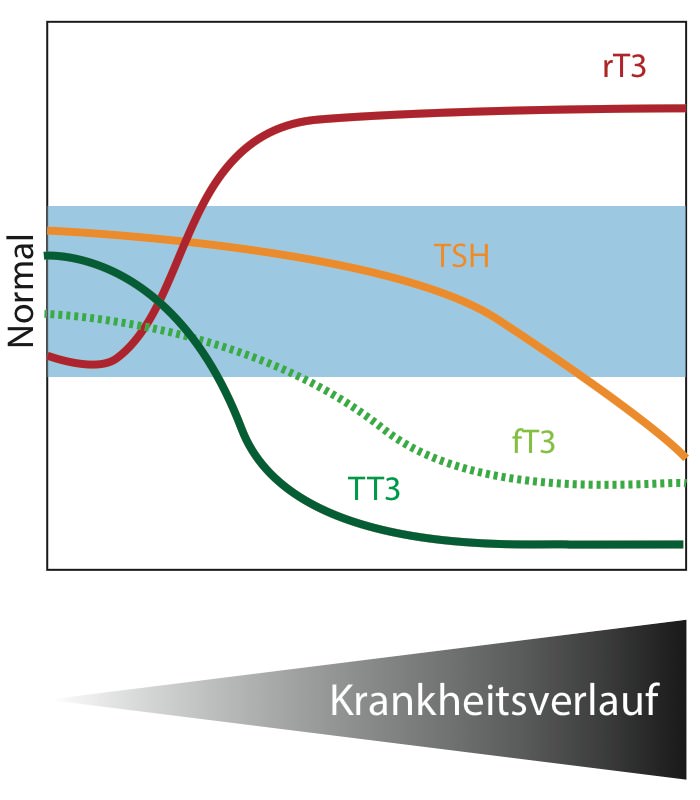
Abbildung 1: Schema der typischen Veränderungen der relevanten Schilddrüsenparameter im Serum
Typischerweise beobachtet man einen ausgeprägten Abfall des Gesamt-T3 (TT3). Der freie Anteil des T3 (fT3) fällt häufg erst mit zunehmender Verschlechterung des Zustands. Typisch ist der starke Anstieg des inaktiven rT3. Die Spiegel des gesamten und freien T4 bleibt meistens konstant und TSH ist normal bis leicht erniedrigt (2 Warner & Beckett, 2010).
Anmerkung:
Lange Zeit herrschte Unklarheit darüber wie sich die freien Hormonwerte bei diesem Zustand verändern (fT3 gestrichelte Linie). Regelmäßig wurden Diskrepanzen dokumentiert, wann und wie stark fT3 abfällt. Inzwischen ist klar, dass diese Verwirrung der Verwendung unzuverlässiger Messmethoden und Artefakten geschuldet waren
(3 Beckett, 2006; 4 Faber & Siersbaek-Nielse, 1996; 5 Christofides et al., 1999). Bei den besagten Patienten liegen nämlich außergewöhnlich wenige Schilddrüsenhormon-Bindeproteine im Serum vor. Auf Grund dieser abnormal-geringen Bindungskapazität liefern manche Methoden ein verfälschtes Ergebnis. Das obige Diagramm ist angelehnt an Messung mit den beiden Goldstandard-Methoden, der Ultrafiltration oder Equilibriums-Dialyse des Serums mit geringem Verdünnungsgrad (2 Warner & Beckett, 2010).
Aber nicht nur Schwerkranke:
All das bestrifft oftmals in gewisser Weise auch Mister (und besonders Miss) Fitnessfreak.
Das oben beschriebene klinische Bild zeigt sich in ähnlicher Form als Folge von aggressivem Diäten, exzessivem Sport oder einer geringen Kohlenhydratzufuhr. Häufig bürden sich entsprechende Personen mehrerer dieser Stressoren gleichzeitig auf, welche sich summieren und im sogenannten Low-T3-Syndrom resultieren können. Äquivalent werden für diesen Zustand häufig die Bezeichnungen euthyroid-sick syndrome oder non-thyroidal illness syndrome verwendet, auch wenn geringfügige Unterschiede bestehen.
Info
Wieder einmal sind Frauen von diesem Syndrom deutlich häufiger betroffen. Ganz besonders (Ausdauer-)Sportlerinnen im Kaloriendefizit tun sich oftmals keinen Gefallen mit ihrem Lebensstil. Das Hauptproblem: Ein zu großes Energiedefizit (6 Boyden et al., 1982; 7 Boyden et al., 1984; 8 Loucks et al., 1993; 9 Loucks et al., 1994)
Man könnte den Eindruck gewinnen, dass in der medizinischen Gedankenblase folgendes herumschwirrt, wenn Mr./Ms. Fitnessfreak auf dem Stuhl sitzt: Ärzte schenken diesem Syndrom in dem betrachteten Kontext häufig keine sonderliche Beachtung.
Der TSH-Wert ist leider der oftmals einzige abgenommene Wert und dieser ist bei den Betroffenen meist lange noch normal. Der Abfall an TT3 (und evtl. fT3) sowie vor allem der dramatische Anstieg an inaktivem rT3 wären eindeutige Alarmsignale. Gerade Letzteres wird selten bestimmt. Dabei wurde in gesunden Männern schon 1984 gezeigt, dass eine marginal negative Energiebilanz (-15%) zu einer deutlichen Verschiebungen des T4/T3 und vorallem des T3/rT3 Verhältnisses führt (10 Garrel et al., 1984).
”Sportlich aktiv und so ein beeindruckendes Sixpack. Nur vom Anschauen des Essens zunehmen – vermutlich übertrieben. Die Abgeschlagenheit ist wohl ein Resultat von Übertraining”.
Häufig können sich Ärzt aber nicht vorstellen, mit was für einer Disziplin diese Hobbysportler an die Sache herangehen und welche Brechstangen sie im Gepäck haben. Diese heißen extremes Kaloriendefizit, Low-Carb oder sogar Ketogene Diäten, die meiste Zeit des Tages Fasten und Sport bis zum Abwinken.
Die Gefahren werden in meinen Augen deutlich unterschätzt.
In der Literatur findet sich bezüglich des Low-T3-Syndroms vor allem Studien in schwerkranken Patienten. Das ist natürlich eine andere Situation als die von Mr./Ms. Fitnessfreak. Die Grundsituation ist dennoch ähnlich: Großer Stress für den Körper und Drosselung des Stoffwechsels.
Die jeweils beobachtete Dynamik der Schilddrüsenhormone ist voraussichtlich zu einem gewissen Teil übertragbar.
Die Darstellung der biologischen Prozesse soll sensibilisieren – don’t mess with your thyroid
Ein kurzer Nahrungsentzug im Nager (12-24 Stunden) um einen ähnlichen Zustand zu erzeugen (11 Boelen et al., 2008). Mit Hilfe dieses Modells versucht man zu verstehen, warum man diese und jene Blutwerte in den jeweiligen Personen beobachtet. Und das fand man bisher heraus:
Die periphere Komponente des “Low-T3-Syndroms”
Zur Erinnerung:
Im Low-T3-Syndrom ist also die Konzentration des gesamten T3 stark reduziert. Das hängt mit der sogenannten “Akute-Phase-Reaktion” zusammen: Ein Schutzmechanismus des Körper in kritischen Situationen. Charakteristisch für diese Reaktion ist die reduzierte Proteinbiosynthese und der verstärkten Proteinabbau in der Leber, vor allem von Serumproteine (12 Jirasakuldech et al., 2000). Besonders betroffen sind hiervon die Transportproteine von lipophilen (= fettlöslichen) Hormonen. Dies umfasst auch die aus Teil II bekannten drei Klassen:
Thyroxin-binding Globulin, Thyroxin-binding Prä-Albumin (Transthyretin) und Albumin.
Info
Es wurde gezeigt, dass thyroxin-binding globulin zum Beispiel nach Bypass-Operationen innerhalb von 12 Stunden um 60% abfallen kann (13 Afandi et al., 2000)! Nagetiere sind typischerweise sehr empfindlich für kurze Phasen von Nahrungsentzug oder Entzündungen. Sie reagieren mit einem ausgeprägte Abfall an Serum-Transthyretin, dem in diesen Spezies bedeutendsten Transportprotein (14 Dickson et al., 1983; 15 Wade et al., 1988).
Chronische Radikal-Diät in Kombination mit Sportexzess werden einen ähnlich destruktiven Einfluss auf diese Transportproteine im Serum nehmen (Energiekonservierung). In der Folge können weniger Schilddrüsenormone gebunden, transportiert ung gespeichert werden. Auf Grund dieser geringeren Bindungskapazität des Serums fällt vor allem das TT3.
Der Anstieg an inaktivem rT3 – Eine weitere Besonderheit des Low-T3-Syndrom
Es liegt auf der Hand, dass hierfür Verschiebungen der Enzymaktivität verantwortlich sind. Also die Konversion von T4 zu T3 bzw. rT3 über die Deiodinasen (siehe Teil II).
Als einigermaßen gesichert gilt die gesteigerte Aktivität der 5-Deiodierung über die D3-Deiodinase. Wie wir wissen, führt das letztendlich zu Mehr inaktivem rT3.
Im Kontext des Low-T3-Syndroms wird D3 auch verstärkt in der Skelettmuskulatur expremiert, obwohl das Enzym dort normalerweise überhaupt nicht (oder kaum) vorkommt (16 Peeters et al., 2003; 17 Peeters et al., 2005). Zusätzlich ist der Abbau und die Ausscheidung von rT3 beeinträchtigt, was für eine weitere Akkumulation sorgt.
Gestörte Konversion in T3 – Symptom oder Ursache?
Auf der anderen Seite wird eine verringerte Aktivität der 5′-Deiodierung vermutet. Die enzymatische Konversion von T4 zu T3 wird durch die zwei weiteren Deiodinasen vermittelt:
D1 (Leber/Niere) und D2 (Muskel).
Einige Daten aus Tier- und Humanstudien sprechen tatsächlich dafür, dass die Aktivität beider Enzyme im Low-T3-Syndrom eingeschränkt sein könnte (16 Peeters et al., 2003; 17 Peeters et al., 2005; 18 Koenig; 2007; 19 Jaksobs et al., 2002; 20 Debaveye et al., 2008).
Ob dies eine Ursache oder ein Symptom ist bleibt weiterhin unklar (21 O’Mara et al., 1993). Im Kontext von chronisch-kranken Patienten konnte eine Studie keine Reduktion der im Menschen so bedeutende D2-Aktivität im Muskel feststellen (22 Mebis et al., 2007).
Allerdings ist es gut möglich, dass das in diätenden Sportlern anders aussieht. Verglichen mit Intensivstationspatienten sind diese ja alles andere als bettlägrig und zwingen ihre Muskeln bei wenig verfügbarer Energie zu Höchstleistung. Verschiedene Spekulationen wie sich so etwas auf die T4-Konversion im Muskel auswirkt sind möglich – es fehlen leider die Daten dazu.
Fazit
Eine gestörte Konversion in T3 scheint zwar Teil des Krankheitsbildes – nicht aber der Initiator des Low-T3-Syndroms zu sein. Hier werden eher Mechanismen im Gehirn vermutet (23 De Groot, 2006; 24 Bianco & Kim, 2006; 25 St. Germain et al., 2009).
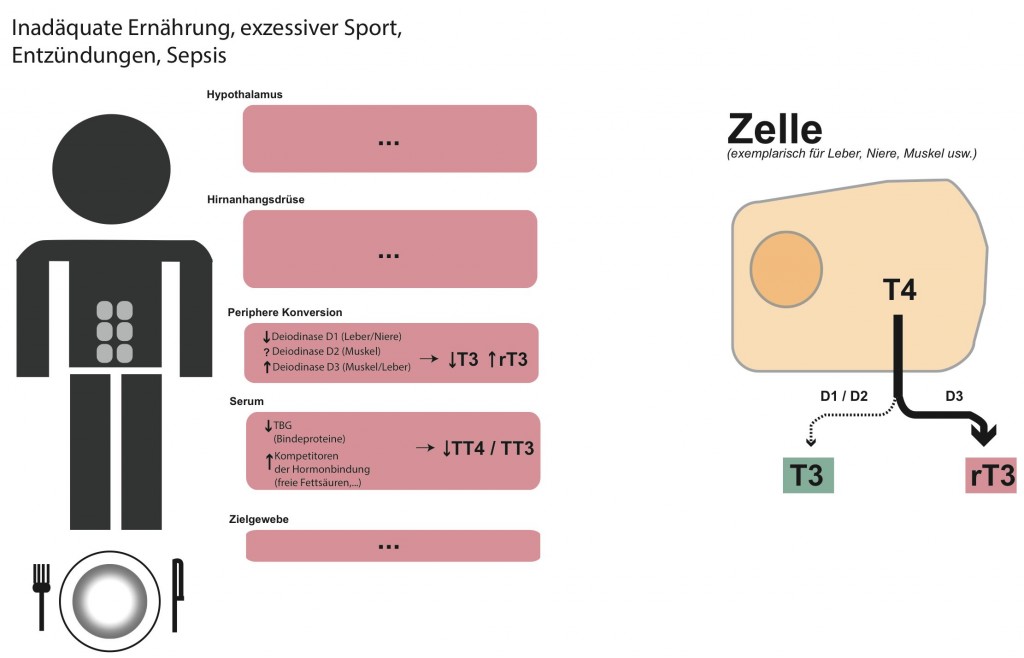
Abbildung 2: Schematische Darstellung der involvierten Faktoren im Low-T3-Syndrom (angelehnt an Warner & Beckett, 2010)
Mr. Sixpack mit einem leeren Teller soll eine inadäquate Ernährung und exzessiven Sport symbolisieren. Dieses Verhalten ist auf verschiedenen Ebenen destruktiv für die Schilddrüsenhormone.
Unter anderem wird die enzymatische Konversion beeinträchtigt. Das T4 wird von den entsprechenden Zellen und Enzymen zunehmend zu rT3 deiodiert. Dadurch fällt das T3/rT3 Verhältnis.
An dieser Stelle möchte ich die Darstellung noch unvollständig präsentieren. In den folgenden Teilen wird sie zu einem ganzheitlichen Bild ergänzt. Vor allem die sehr bedeutende Gehirnkomponente wird ausgiebig beleuchtet.
Info
Die Chronobiologie ist ein aufsteigendes Forschungsfeld, welches den Einfluss von circadianen Rhythmen auf die Physiologie adressiert. Bekanntermaßen schwanken viele Hormone im Tagesverlauf. Aufgrund der leichten, analytischen Zugänglichkeit erregen diese perpetuierende, hormonellen Oszillationen großes Interesse. Für Schilddrüsenhormone bestehen inzwischen Hinweise sowohl für diurnale (= 24 h) als auch saisonale Schwankungen (26 Campos-Barros et al., 1997; 27 Russell et al., 2008; 28 Ebling, 2014). Diese scheinen von der Photoperiode beziehungsweise der Tageslänge reguliert zu werden.Nebst diesen nicht zu beeinflussenden Rhythmen schwingt der Organismus selbst den Taktstock. In den meisten Tieren erfolgt die Nahrungsaufnahme in diskreten Mahlzeiten, welche in der Aktivitätsphase des Tiers z. B. durch hormonelle Vorbereitungen antizipiert werden (29 Cummings, 2006).
Wird Nagern ein striktes Futter-Schema auferlegt (2-3 Stunden Futterzugang pro Tag) stellt man ein sogenanntes “food entrainment” fest. Die Physiologie und die Hormone passen sich an das begrenzte Essensfenster an (30 Díaz-Muñoz et al., 2000; 31 Eckel-Mahan et al., 2013). Mit Hinblick auf die Schilddrüsenhormone wurde herausgefunden, dass die Aktivität der Deiodinase D1 in der Leber an die Nahrungsaufnahme synchronisiert wird (32 Aceves et al., 2003). Das Stoffwechsel-anregende T3 wird letztendlich kaum in der Fastenphase, dafür sehr ausgeprägt nach dem Fressen in der Leber generiert. Haben die Ratten unbegrenzten “ad libitum” Zugang zum Futter sind diese Schwankungen weniger ausgeprägt (32 Aceves et al., 2003).
Beim Menschen kennt man ebenfalls ein solches “food entrainment” im Kontext verschiedener anderer Hormone (33 Schoeller et al., 1997). Es ist davon auszugehen, dass Ansätze wie das intermittierende Fasten auch beim Menschen auf die Produktion von T3 wirken. Ob und in welchem Fall das negative Folgen hat ist nicht abzuschätzen. Es ist aber sicherlich abhängig von vielerlei anderer Faktoren wie dem Sportpensum und Kaloriendefizit, der Fastendauer et cetera.
Low-T3-Syndrom und die Selenzufuhr
Langsam nähern wir uns den tatsächlich implementierbaren Dingen. Wir wissen aus Teil II, dass Deiodinasen sogenannte Selenoproteine sind. Sie benötigen somit Selen um wirklich funktionsfähig zu sein. Eine schwere Selendefizienz in Nagern resultiert in einer Abnahme an D1 und einem dysregulierten Schilddrüsenhormonstatus (34 Beckett et al., 1989; 35 Meinhold et al., 1993).
Im Menschen korrelieren niedrige Selenspiegel mit dem Low-T3 Syndrom. Nachgewiesen wurde das zum Beispiel in schwerkranken Patienten, in Personen in abgelegenen Gebieten mit limitierter Selenzufuhr (z.B. Afrika) oder Phenylketonurie-Patienten mit einer Spezialernährung (36 Arthur et al., 1993; 37 Olivieri et al., 1995; 38 Contempré et al., 1991; 39 Calomme et al., 1995a; 40 Calomme et al., 1995b; 41 Lehmann et al., 1997).
Diese Korrelation sagt einem aber noch lange nichts über einen kausalen Zusammenhang!
Es ist aber nicht von der Hand zu weisen, dass eine Selen-Supplementation in diesen Risikogruppen eine deutliche Verbesserung der Schilddrüsenhormone bewirkt. Trotzdem wäre ich mit einer Generalisierung vorsichtig. Mit Hinblick auf diese recht dramatischen und multifaktoriellen Zustände kann man sicherlich Zweifel anbringen bezüglich der direkten Übertragbarkeit auf Mr./Ms. Fitnessfreak (42 Angstwurm et al., 2004).
Ich habe nun einige Zeit in die Recherche investiert und bin leider zu keinem eindeutigen Ergebnis gelangt. Die Datenlage bezüglich Selen und der Schilddrüse ist inkonsistent und man stößt regelmäßig auf erhebliche Spezies-und Kontextabhängigkeiten (review in 43 Koehrle, 2005).
Selenspiegel und die Empfehlung auf edubily
Info
Als Biomarker misst man das Selen im Serum (innerhalb von α/β Globulin und Lipoproteinen), in Erythrocyten/Vollblut, im Urin oder in Haarproben (44 Lockitch, 1989; 45 Thomson, 2004; 46 Ashton et al., 2009).Die Referenzwerte sind:
- für das Serum mit 50-120 μg/l
- für das Vollblut mit 75-140 μg/l
- für Urin mit 5-30 μg/l
angegeben. Diese Empfehlungen stammen von der Deutschen Gesellschaft für Ernährung (1984). Es sind generell etwas höhere Werte anzustreben (200 μg/l). Wichtig ist aber, dass der “optimale” Selenspiegel durchaus als individuell und relativ angesehen werden kann. Epigenetische Veränderungen und Hormesis (=Abhärtung) in Personen, welche auf sehr selenhaltigen Böden leben, ermöglichen diesen “theoretisch” toxische Selenspiegel im Blut bei blendender Gesundheit. Will heißen: Es diesen Menschen nachzumachen und plötzlich seinen Selenspiegel rapide zu verändern – sagen wir von einem Mangel auf über 200 μg/l – ist vielleicht auch nicht die beste Idee.
Übrigens werden die Symptome eines Selenmangels durch reduzierte Spiegel an α- und vor allem γ-Tocopherol (Vitamin E) verstärkt .
Aber: Überschätzte Aussagekraft der Selenspiegel für die Deiodierung?!
Alle diese Messungen der Selenspeicher scheinen allerdings wenig Aufschluss darüber zu geben, wie es um die Deiodierung und damit die T4/T3 Ratio bestellt ist.
Der allgemeine Konsens ist, dass – sofern kein ernsthafter Selenmangel vorliegt – der exakte Selenstatus für die T4/T3 Konversion kaum relevant ist (43 Koehrle, 2005; 46 Ashton et al., 2009).
Warum das?
Man nehme zum Beispiel die Proteine Glutathion-Peroxidase oder das Selenoprotein P. Das sind jeweils Indikatoren für die zellulären Selenspeicher beziehungsweise die systemische Transportform (47 Persson-Moschos et al., 1998). Verglichen mit den Deiodinasen sind beide Proteine um ein Vielfaches häufiger im Körper vorhanden. Außerdem reagieren sie recht sensibel auf die Selenzufuhr und nehmen bei einem Mangel signifikant ab.
Die deutlich selteneren Deiodinasen sind hingegen selbst bei geringer Selenzufuhr abgesättigt. Man vermutet, dass sie auf Grund ihrer zentralen Bedeutung zuerst mit dem verfügbaren Selen versorgt werden (43 Koehrle et al., 2005).
D2 und D3 scheint in der Hierarchie eine nochmals höhere Position einzunehmen als D1, da bei einem schweren Selenmangel nur D1 abnimmt.
Info
Eine solch hierarchische Versorgung mit Mikronährstoffen spielt auch bei der “Triage Theorie” von Professor Bruce Ames eine zentrale Rolle (48 McCann and Ames, 209; 49 Ames, 2010).
Zu viel Selen – potentiell eine Gefahr?
Im Laufe der Recherche bin ich auch auf eine beunruhigende Studie gestoßen, die natürlich auch vermerkt und diskutiert werden will.
Entgegen den Erwartungen bewirkte in gesunden Männern eine Selen-reiche Kost (300 μg/d) verglichen mit einer Selen-armen (14 μg/Tag) eine Abnahme an Serum T3, Anstieg an TSH und eine Körpergewichtszunahme (50 Hawkes et al., 2001a). Interessant ist hierbei, dass die beiden Gruppen für 120 Tage dieselbe Nahrung verarbreicht bekamen, was streng kontrolliert wurde. Das Lesen des Methodenteils der Studie lässt ein gewisses Knast-Feeling aufkommen: 120 Tage kontrolliert und immer das selbe Essen. Aber das soll uns hier nicht stören.
Die Ernährung der Insassen … ähhh … Studienteilnehmer war identisch, nur das verabreichte Fleisch unterschied sich im Selengehalt aufgrund des Herkunftsland (selenhaltiges Futtermittel in USA vs. Neuseeland) (51 Hawkes et al., 2001b).
Als Kritik lässt sich hier anbringen, dass die Fleischherkunft nicht nur Auswirkungen auf den Selengehalt haben könnte. Ich könnte mir vorstellen, dass neuseeländische Rinder z.B. öfter mal Gras und Heu zu sehen bekommen als das typische US Rind.
Ein viel größeres Problem der Studie ist aber Folgendes:
Der Selenstatus der Teilnehmer wurde zu keinem Zeitpunkt der Intervention gemessen!
Es ist leider ein grundlegendes Problem vieler solcher Studien, dass die tatsächlich beeinflussten Paramter vor und nach der Intervention überhaupt nicht adäquat bestimmt werden. Somit werden Personen mit einem Mangel und Überschuss in ein und den selben Topf geworfen. Die Aussagekraft der Studie ist somit fragwürdig. Chris predigt es immer:
Kenne deine Blutwerte!
Obwohl die Relevanz der Selen-Marker angezweifelt wird, sind Bluttest insbesondere vor Supplementierungen notwendig. Nicht nur die obige Studien unterstützt die Annahme, dass zuviel Selen durchaus inhibierend auf die Deiodierung wirken kann. 300-500 μg wird für den Menschen als generelle Obergrenze angegeben, die RDA beträgt 55-70 μg/Tag für Erwachsene (52 Food and Nutrition Board, 2000).
Falls zusätzlich eine starke Iodid-Defizienz vorliegt ist eine Selen-Gabe sogar außerordentlich gefährlich (38 Contempré et al., 1991).
Insulin-Resistenz durch Selen?
Das oben erwähnte Selenoprotein P steht neben seinen vielen protektiven Effekten außerdem im Verdacht eine Insulin-Resistenz zu begünstigen (53 Misu et al., 2010; 54 Bleys et al., 2007, 55 Stranges et al., 2010; 56 Chateau-Degat et al., 2010). Zusätzlich kann die Gluthathion-Peroxidase auf molekularer Ebene mit den Insulin-Signalwegen inteferieren. Fazit: Ein Selen-Exzess kann theoretisch auch die Blutzuckerkontrolle beeinträchtigen.
Selen – ja oder nein?
Mein Gefühl sagt mir, dass gerade bei Mr./Ms. Fitnessfreak bedeutend wichtigere Faktoren zuerst behoben werden müssen.
Grundsätzlich ist hier die Kalorienbilanz das Hauptproblem. Vermutlich gefolgt von pro-inflammatorischen Cytokinen.
Welche Rolle spielen Entzündungen?
Wichtig ist, das haben wir heute kaum besprochen, dass rT3 (das „inaktivierte T3) durch Entzündungsreaktion im Körper ansteigt. Chronische Entzündungen, wie beispielsweise hervorgerufen durch Langzeitinfekte (z. B. Epstein-Barr), durch zu viel Abdominalfett oder sonstigen Ursachen, beeinträchtigen den Schilddrüsenhormonhaushalt massiv.
Viele erfolgreiche Selbsthelfer konnten ihre fT3-Werte normalisieren, alleine durch Verbesserung des Entzündungsstatus‘ des Körpers. Zwar finden sich dafür Hinweise in der Literatur, aber die anekdotische „Beweislage“ scheint eindeutig zu sein. Diesebezüglich gibt es einige Forummitglieder, die Erfahrungen gemacht haben. Interessant ist, dass proinflammatorische Cytokine direkt auf das Gehirn wirken und der schlechte Schilddrüsenhormonhaushalt wohl durch eine neuronale Komponente verursacht wurde.
Meiner Meinung nach ist es natürlich nach wie vor empfehlenswert den Selenstatus im Auge zu behalten und sich im oberen Referenzbereich aufzuhalten. Unabhängig davon, ob die Deiodierung als konstitutiver Parameter von Selen beeinflusst werden kann oder nicht.
Es bestehen nämlich unzählige Hinweise für ein durch Selen abgesenktes Risiko für kardiovaskuläre Erkrankungen, Krebs, Neurodegeneration und vieles mehr.
Für Menschen mit Autoimmunerkrankungen wie Hasthimoto Thyreoditis sieht die Empfehlung aber etwas anders aus. Hier bestehen Hinweise, dass zusätzliches Selen die Autoimmunreaktion abmildert. Und nicht nur Personen mit messbarem Mangel sondern auch Betroffene mit adäquaten Selenspiegeln profitieren von einer Supplementierung. Nach der Intervention wiesen die Betroffenen weniger autoreakive TPO-Antikörper auf (57 Turker et al., 2006).
Info
Selen wird nicht nur für die periphere Konversion von T4 in T3 benötigt. Selen kommt in hohen Konzentrationen in der Schilddrüse selbst vor. Dort ist es Teil des Enzyms Glutathion-Peroxidase, welches im Follikellumen der Schilddrüse vorhanden ist. Dieses Enzym kontorlliert das Aufkommen von oxidativem Stress (H2O2) und die Iodisation von Thyreoglobulin. Letztendlich steigert Selen darüber die Bildung der Schilddrüsenhormone (58 Howie et al., 1995).Mit Hinblick auf Hashimoto Thyreoditis wurde gezeigt, dass eine Supplementierung mit Selen zu einer Abmilderung der Entzündungsprozesse in der Schilddrüse führte (59 Gaertner et al., 2002).
Grund hierfür ist vermutlich die höhere Konzentration von Glutathion-Peroxidase und Thioredoxin Reductase – selenabhängige Schlüsselstelle des körpereigenen anti-oxidativen Systems (60 Mazokopakis et al., 2005).
Supplementierungsmöglichkeiten – ein Überblick
Wir nehmen Selen über die Nahrung in verschiedenen Verbindungen auf. Die jeweilige Verbindung beeinflust Absorption und die biologische Effekte. Selbiges gilt genauso für die verschiedenen Supplementierungsformen (61 Christensen et al., 1983; 62 Whanger & Butler, 1988; 63 Finley et al., 2001).
Natriumselenit ist eine anorganische Form, welche spezifisch in Selenoproteine eingebaut wird. Für die menschlichen Ernährung spielt Selenit in der Regel keine große Rolle, kann allerdings theoretisch als Supplement verwendet werden. Für das Einstellen der Bluwerte bieten sich die Serumspiegel an. Für Selenit wurden allerdings mehrere nachteilige Wirkungen dokumentiert inklusive einer Depletion von Glutathion, pro-oxidative Eigenschaften und einer Inhibition der RNA-Synthese (64 Caffrey et al., 1991; 65 Shen et al., 1999; 66 Frenkel et al., 1989). Es wird vor allem in Tierversuchen als Supplement eingesetzt.
Selenomethionin ist das am meisten verwendete Supplement, kommt aber auch häufig in pflanzlichen und tierischen Lebensmitteln vor. Selenomethionin wird anstelle des klassischen Methionins, einer schwefelhaltigen Aminosäure, in Muskel-, Erythrozten- und Plasmaproteinen eingebaut. Diese Inkorporation fungiert letztendlich als Speicher. An dieser Stelle sollte man allerdings anmerken, dass der Körper eigentlich nicht Selenomethionin sondern Selenocystein benötigt. Das ist die zweite, selenanaloge Aminosäure, die in der klassischen Form ein Schwefelatom trägt. Es ist dieses Selenocystein, welches in den katalytischen Zentren der Selenoproteine benötigt wird.
Während Selen in diesen Enzymen absolut notwendig ist, um biochemisch Reaktionen zu katalysieren (z. B. T4-T3-Konversion), kann das zufällige Einbauen von Selenomethionin in Blut-und Muskelproteine eventuell zu einem Problem werden.
Selen hat nämlich einen größeren atomaren Radius als Schwefel. Außerdem bestehen weitere chemische Unterschiede zwischen der schwefeligen Sulhydryl- und der Selenolgruppen, wie zum Beispiel das Dissoziations- und Oxidationsverhalten.
Aufgrund dieser Fakten besteht die Vermutung, dass die Funktionalität der Proteine ab einer gewissen Selenakkumulation leiden könnte.
Geeignete Biomarker um per Selenmethionin seinen Status einzustellen wäre Vollblut oder Erythrocyten (Langzeitspeicher).
Selenocystathionin ist ein Intermediat im pflanzlichen Selenstoffwechsel. Gewisse Pflanzen, sogenannte Selenakkumulatoren, stoppen bei dieser Zwischenstufe und vermeiden somit die Bildung von Selenocystein und Selenomethionin. Das ist ein großer Vorteil für diese Pflanzen, welche häufig auf sehr selenhaltigen Böden wachsen. Sie vermeiden dadurch den drohenden Einbau von selenanalogen Aminosäuren in wichtige Proteine.
Selenocystathionin ist zwar auch eine Aminosäure, ist aber nicht proteinogen und wird in freier Form selektiv in den Samen/Nüsse angereichert (67 Aronow & Kerdel-Vegas, 1963).
Nehmen Tiere oder Menschen das Selen in dieser Form auf, könnten auch sie in den Genuss dieser Vorteile kommen: Die Zufuhr der direkten Vorstufe von Selenocystein ohne die Gefahr einer möglicherweise nachteiligen Selenomethionin-Akkumulation in anderen Proteinen.
Von welchen Samen/Nüssen sprechen wir?
Zwei typische Selenakkumulatoren sind die Paranuss und die weniger bekannte Paradiesnuss (68 Andrade et al., 1998). Beide wachsen im Amazonasgebiet auf oftmals sehr selenhaltigen Böden. Das Vorkommen der Paranuss ist auf eine Größere Fläche verteilt, was in schwankenden Selenkonzentrationen resultiert (69 Palmer & Herr, 1982; 70 Secor & Donald, 1989; 71 Chang et al., 1989; 72 Vonderheide et al., 2002; 73 Pacheco & Scussel, 2007). Die regional-beschränkte Paradiesnuss ist diesbezüglich einheitlicher.
Persönliches Vorgehen:
Man hat zwar verglichen mit Selenomethionin weniger Kontrolle über die tatsächliche Zufuhr –
ich persönlich bevorzuge aber wann immer möglich die “whole-food”-Variante. Deshalb baue ich alle paar Tage eine handvoll Paranüsse ein, welche zusätzlich günstig auf die Blutfettwerte wirken sollen (74 Thomson et al., 2008; 75 Maranhao et al., 2011).
Das Selenwert-Paradoxon – ein Kommentar von Chris
Da wir uns wissenschaftlich und fachlich korrekt mit Materien auseinandersetzen wollen, müssen wir anerkennen, dass wir bezüglich Selen und T3-Haushalt an unsere Grenzen kommen. Dem war leider schon vor 4 Jahren so, als ich tief in der Patsche steckte und einzig der Glaube an meine „Selen/Jod-Kombi“ geholfen hat, mit der Situation adäquat umzugehen.
Auch damals war die Datenlage, sagen wir: schwammig. Dies hat Tim sehr gut dargestellt, ich habe ihn sogar anfänglich darauf angesprochen. Doch was soll man tun, wenn die Praxis eindeutig bewiesen hat, dass etwas funktioniert, doch die Theorie lässt an der Intervention zweifeln?
Tim und ich hatten ein nettes und ausführliches Gespräch darüber und beide sind wir uns auch über die Grenzen der Studienmethodik im Klaren. Wir wissen beispielsweise sehr häufig gar nichts über die absoluten Protein-Werte (z. B. Deiodinasen), sondern nur über das abgelesen DNA-Produkt, die mRNA – das Protein muss dann allerdings erst noch gebildet werden. Die mRNA-Werte also sagen nichts über die absoluten Proteinmengen im Endeffekt aus. Darüberhinaus ist auch die Proteinaktivität an sich kein Maß, denn hier wird die Menge nicht berücksichtigt. Wir wissen außerdem sehr wenig über die tatsächliche Eigenschaften von Deiodinasen: Ist der T3-Wert im Blut überhaupt aussagekräftig oder doch nur ein Maß der hepatischen T4-T3-Konversion? Denn jedes Gewebe baut für sich T4 in T3 um, was erneut neue Frage aufkommen lässt: Es konnte gezeigt werden, dass selbst bei starkem Selenmangel, der Selenwert im Gehirn nicht abfällt.
Umgekehrt lässt dies den Schluss zu, dass das Gehirn vielleicht eine normale T3-Versorgung aufweist, der Muskel aber schon längst nicht mehr (deckt sich mit Ames‘ „Triage“-Theorie). Gehen wir davon aus, dass der T3-Wert im Blut wenig aussagekräftig ist, dann muss man anerkennen, dass man den intrazellulären (= innerhalb der Zelle) T3-Wert gar nicht bestimmen kann und somit auch keine Aussage diesbezüglich getroffen werden kann. Nun weiß ich aus eigener Erfahrung, dass in mir die Sonne aufging, als der Selenwert passte.
Gleiches Phänomen beschrieb Dr. Strunz aus Roth, der dies auf „Entgiftung“ von Schwermetallen zurückführte, die bekanntlich auch im Nervensystem lagern können. Gleichzeitig verweist er bezüglich seines hohen T3-Werts auf seine ausreichende Selenzufuhr. Ich bin mir sicher, dass das Gefühl bei Dr. Strunz und mir durch eine bessere T3-Versorgung des Gehirns hervorgerufen wurde.
Uns ist wichtig, dass dir auch die Limitationen und der Theorie-Praxis-Zwiespalt klar wird. Ansonsten bleibt zu sagen, dass die Datenlage bezüglich Selenzufuhr und T3-Wert dünn ist und allerhöchstens eine negative Konsequenz bei deutlichen Mängeln zu erwarten wäre, zumindest laut der Arbeiten. Es bleibt abzuwarten, ob die Zukunft andere Messmethoden etc. hervorbringt. Dennoch möchte ich klarstellen, dass ich eure Selenwerte kenne und weiß, dass man besser einmal nachmessen sollte. Ich distanziere mich aber klar von pauschalisierter „Hochdosis-Therapie.
Preview
Inzwischen habe ich den geplanten Aufbau der Reihe etwas über den Haufen geworfen. Der Übersichtlichkeit halber wurde alles etwas entzerrt und auf mehrere, dafür hoffentlich übersichtlichere Artikel verteilt.
In Teil IV werden einige positive wie auch negative Einflüsse auf die Schilddrüse gelistet und diskutiert. Diese reichen von “A” wie Anti-Nährstoffe über “B” wie Bisphenol A hin zu “Z” wie Zink. Zusätzlich kommen gewisse Makro-Verteilungen zur Sprache, insbesondere die Rolle von Kohlenhydraten. Und immer schön entspannt, denn emotionaler Stress hat auch Auswirkungen, wie wir sehen werden.
Im voraussichtlich letzten Teil der Artikelreihe, Teil V, werde ich die Gehirnkomponente im Zusammenhang von exzessivem Sport und radikalen Ernährungen beleuchten. Es wird darum gehen, wie der Hypothalamus ein Kaloriendefizit, Entzündungen oder Jahreszeiten wahrnimmt und wie er in der Folge die Schilddrüsenachse anpasst.
Referenzen
1 Ray DC, Macduff A, Drummond GB, Wilkinson E, Adams B, Beckett GJ (2002) Endocrine measurements in survivors and non-survivors from critical illness. Intensive Care Medicine.
2 Warner MH and Beckett GJ (2010) Mechanisms behind the non-thyroidal illness syndrome: an update. Journal of Endocrinology.
3 Beckett GJ (2006) Thyroid function and thyroid function tests in non-thyroidal illness. CPD Bulletin: Clinical Biochemistry
4 Faber J & Siersbaek-Nielsen K (1996) Serum free 3,5,30-triiodothyronine (T3) in non-thyroidal somatic illness, as measured by ultrafiltration and immunoextraction. Clinica Chimica Acta
5 Christofides ND, Wilkinson E, Stoddart M, Ray DC, Beckett GJ (1999) Assessment of serum thyroxine binding capacity-dependent biases in free thyroxine assays. Clinical Chemistry.
6 Boyden TW, Pamenter RW, Stanforth P, Rotkis T, Wilmore JH (1982) Evidence for mild thyroidal impairment in women undergoing endurance training. J Clin Endocrinol Metab.
7 Boyden TW, Pamenter RW, Rotkis TC, Stanforth P, Wilmore JH (1984) Thyroidal changes associated with endurance training in women. Med Sci Sports Exerc.
Howie, A. F., Walker, S. W., Ake
8 Loucks AB, Callister R (1993) Induction and prevention of low-T3 syndrome in exercising women. Am J Physiol.
9 Loucks AB, Heath EM (1994) Induction of low-T3 syndrome in exercising women occurs at threshold of energy availability. Am J Physiol.
10 Garrel DR, Todd KS, Pugeat MM, Calloway DH. Hormonal changes in normal men under marginally negative energy balance. Am J Clin Nutr 1984
11 Boelen A, Wirsinga WM, Fliers E (2008) Fasting-induced changes in the hypothalamus-pituitary-thyroid axis. Thyroid.
12 Jirasakuldech B, Schussler GC, Yap MG, Drew H, Josephson A, Michl J (2000) A characteristic serpin cleavage product of thyroxine-binding globulin appears in sepsis sera. Journal of Clinical Endocrinology and Metabolism.
13 Afandi B, Schussler GC, Arafeh AH, Boutros A, Yap MG, Finkelstein A (2000) Selective consumption of thyroxine-binding globulin during cardiac bypass surgery. Metabolism.s
14 Dickson PW, Howlett GJ, Schreiber G (1982) Metabolism of prealbumin in rats and changes induced by acute inflammation. European Journal of Biochemistry.
15 Wade S, Bleiberg-Daniel F, Le Moullac B (1988) Rat transthyretin: effects of acute short-term food deprivation and refeeding on serum and cerebrospinal fluid concentration and on hepatic mRNA level. Journal of Nutrition.
16 Peeters RP, Wouters PJ, Kaptein E, van Toor H, Visser TJ, Van den Berghe G (2003) Reduced activation and increased inactivation of thyroid hormone in tissues of critically ill patients. J Clin Endocrinol Metab. 2003
17 Peeters RP, Wouters PJ, van Toor H, Kaptein E, Visser TJ, Van den Berghe G (2005) Serum 3,3′,5′-triiodothyronine (rT3) and 3,5,3′- triiodothyronine/rT3 are prognostic markers in critically ill patients and are associated with postmortem tissue deiodinase activities. Journal of Clinical Endocrinology and Metabolism.
18 Koenig RJ (2005) Regulation of thype 1 iodothyronine deiodinase in health and disease. Thyroid.
19 Jakobs TC, Mentrup B, Schmutzler C, Dreher I, Kohrle J (2002) Proinflammatory cytokines inhibit the expression and function of human type I 5′-deiodinase in HepG2 hepatocarcinoma cells. European Journal of Endocrinology.
20 Debaveye Y, Ellger B, Mebis L, Darras VM, Van den Berghe G (2008) Regulation of tissue iodothyronine deiodinase activity in a model of prolonged critical illness. Thyroid.
21 O’Mara BA, Dittrich W,LauterioTJ, St. Germain DL(1993) Pre-translational regulation of type I 5′-deiodinase by thyroid hormones and in fasted and diabetic rats. Endocrinology.
22 Mebis L, Langouche L, Visser TJ, Van den Berghe G (2007) The type II iodothyronine deiodinase is up-regulated in skeletal muscle during prolonged critical illness. Journal of Clinical Endocrinology and Metabolism.
23 De Groot LJ (2006) Non-thyroidal illness syndrome is a manifestation of hypothalamic-pituitary dysfunction, and in view of current evidence, should be treated with appropriate replacement therapies. Crit Care Clin.
24 Bianco & Kim (2006) Deiodinases: implications of the local control of thyroid hormone action. J Clin Invest.
25 St Germain DL, Galton VA & Hernandez A (2009) Minireview: defining the roles of the iodothyronine deiodinases: current concepts and challenges. Endocrinology.
26 Campos-Barros A, Musa A, Flechner A, Hessenius C, Gaio U, Meinhold H, Baumgartner A (1997) Evidence for Circadian Variations of Thyroid Hormone Concentrations and Type II 5 ‘-lodothyronine Deiodinase Activity in the Rat Central Nervous System. Journal of Neurochemistry.
27 Russell W, Harrison RF, Smith N, Darzy K, Shalet S, Weetman AP, Ross RJ (2008) Free Triiodothyronine Has a Distinct Circadian Rhythm That Is Delayed but Parallels Thyrotropin Levels. J Clin Endocrinol Metab.
28 Ebling FJP (2014) Hypothalamic control of seasonal changes in food intake and body weight. Frontiers in Neuroendocrinology.
29 Cummings DE (2006) Ghrelin and the short- and long-term regulation of appetite and body weight. Physiol Behav.
30 Díaz-Muñoz M, Vázquez-Martínez O, Aguilar-Roblero R & Escobar C (2000) Anticipatory changes in liver metabolism and entrainment of insulin, glucagon, and corticosterone in food-restricted rats. American Journal of Physiolog.
31 Eckel-Mahan KL, Patel VR, de Mateo S, Orozco-Solis R, Ceglia NJ, Sahar S, Dilag-Penilla SA, Dyar KA, Baldi P, Sassone-Corsi P (2013) Reprogramming of the circadian clock by nutritional challenge. Cell.
32 Aceves C, Escobar C, Rojas-Huidobro R, Vázquez-Martínez O, Martínez-Merlos T, Aguilar-Roblero R, Díaz-Muñoz (2003) Liver 5’-deiodinase activity is modified in rats under restricted feeding schedules: evidence for post-translational regulation. Journal of Endocrinology.
33 Schoeller DA, Cella LK, Sinha MK, Caro JF (1997) Entrainment of the Diurnal Rhythm of Plasma Leptin to Meal Timing. J Clin Invest.
34 Beckett GJ, MacDougall DA, Nicol F, Arthur JR (1989) Inhibition of type I and type II iodothyronine deiodinase activity in rat liver, kidney, and brain produced by selenium deficiency. Biochem J.
35 Meinhold H, Campos-Barros A, Walzog B, Köhler R, Müller F, Behne D (1993) Effects of selenium and iodine deficiency on type I, type II and type III iodothyronine deiodinases and circulating thyroid hormones in the rat. Exp Clin Endocrinol.
36 Arthur JR, Nicol F, Beckett GJ (1993) Selenium deficiency, thyroid hormone metabolism, and thyroid hormone deiodinases. Am J Clin Nutr.
37 Olivieri O, Girelli D, Azzini M, et al. (1995) Low selenium status in the elderly influences thyroid hormones. Clin Sci.
38 Contempré B, Dumont JE, Bebe N, Thilly CH, Diplock AT, Vanderpas J (1991) Effect of selenium supplementation in hypothyroid subjects of an iodine and selenium deficient area: The possible danger of indiscriminate supplementation of iodine deficient subjects with selenium. J Clin Endocrinol.
39 Calomme MR, Vanderpas JB, Francois B, et al. (1995a) Thyroid function parameters during a selenium repletion/ depletion study in phenylketonuric subjects. Experientia.
40 Calomme MB, Vanderpas JB, Francois B, et al. (1995b) Effects of selenium supplementation on thyroid hormone metabolism in phenylketonuria subjects on a phenylalanine restricted diet. Biol Trace Elem Res.
41 Lehmann C, Egerer K, Weber M, et al. (1997) Effect of selenium administration on various laboratory parameters of patients at risk for sepsis syndrome. Med Klin.
42 Angstwurm MWA, Schopohl J, Gaertner R (2004)
Selenium substitution has no direct effect on thyroid hormone metabolism in critically ill patients. European Journal of Endocrinology.
43 Koehrle J (2005) Selenium and the control of thyroid hormone metabolism. Thyroid.
44 Lockitch G (1989) Selenium: clinical significance and analytical concepts. Crit Rev Clin Lab Sci.
45 CD Thomson (2004) Assessment of requirements for selenium and adequacy of selenium status: a review. European Journal of Clinical Nutrition.
46 Ashton K, Hooper L, Harvey LJ, Hurst R, Casgrain A, Fairweather-Tait SJ (2009) Methods of assessment of selenium status in humans: a systematic review. Am J Clin Nutr.
47 Persson-Moschos M, Alfthan G, Akesson B (1998) Plasma selenoprotein P levels of healthy males in different selenium status after oral supplementation with different forms of selenium. Eur J Clin Nutr.
48 McCann JC, Ames BN (2009) Vitamin K, an example of triage theory: is micronutrient inadequacy linked to diseases of aging? Am J Clin Nutr.
49 Ames BN (2010) Prevention of Mutation, Cancer, and Other Age-Associated Diseases by Optimizing Micronutrient Intake. J Nucleic Acids.
50 Hawkes WC, Keim NL (2003a) Dietary selenium intake modulates thyroid hormone and energy metabolism in men. J Nutr.
51 Hawkes WC, Alkan FZ, Oehler L (2003b) Absorption, distribution and excretion of selenium from beef and rice in healthy North American men. J Nutr.
52 Food and Nutrition Board, Institute of Medicine (2000) Dietary Refer- ence Intakes for Vitamin C, Vitamin E, Selenium, and Carotenoids. National Academy Press, Washington, DC.
53 Misu H, Takamura T, Takayama H, Hayashi H, Matsuzawa-Nagata N, Kurita S, Ishikura K, Ando H, Takeshita Y, Ota T, Sakurai M, Yamashita T, Mizukoshi E, Yamashita T, Honda M, Miyamoto K, Kubota T, Kubota N, Kadowaki T, Kim HJ, Lee IK, Minokoshi Y, Saito Y, Takahashi K, Yamada Y, Takakura N, Kaneko S (2010) A liver-derived secretory protein, selenoprotein P, causes insulin resistance. Cell Metab.
54 Bleys J, Navas-Acien A, Guallar E (2007) Serum selenium and diabetes in U.S. Adults. Diabetes Care.
55 Stranges S, Sieri S, Vinceti M, Grioni S, Guallar E, Laclaustra M, Muti P, Berrino F, Krogh V (2010) A prospective study of dietary selenium intake and risk of type 2 diabetes. BMC Public Health.
56 Chateau-Degat ML, Ferland A, Larmarche B, Counil E, Lemire M, Dewailly E (2010) Selenium and type 2 diabetes: insight from a population highly exposed. J Diab Metab.
57 Turker O, Kumanlioglu K, Karapolat I, Dogan I (2006) Selenium treatment in autoimmune thyroiditis: 9-month follow-up with variable doses.yn
58 Howie AF, Walker SW, Akesson B, Arthur JR, Beckett GJ (1995) Thyroidal extracellular glutathione peroxidase: a potential regulator of thyroid-hormone synthesis. Biochem J.
59 Gaertner R, Gasnier BC, Dietrich JW, Krebs B, Angstwurm MW (2002) Selenium supplementation in patients with autoimmune thyroiditis decreases thyroid peroxidase antibodies concentrations. J Clin Endocrinol Metab.
60 Mazokopakis EE, Chatzipavlidou V (2007) Hashimoto’s thyroiditis and the role of selenium. Current concepts. Hell J Nucl Med.
61 Christensen, M. J., Janghorbani, M., Steinke, F. H., Istfan, N. & Young, V. R. (1983) Simultaneous determination of absorption of selenium from poultry meat and selenite in young men: application of a triple stable-isotope method. Br J Nutr.
62 Whanger PD & Butler JA (1988) Effects of Various Dietary Levels of Selenium as selenite or selenomethionine on tissue selenium levels and gluthione peroxidase acitivity in rats. American Institute of Nutrition.
63 Finley JW & Davis CD (2001) Selenium (Se) from high-selenium broccoli is utilized differently than selenite, selenate and selenomethionine, but is more effective in inhibiting colon carcinogenesis. Biofactors.
64 Caffrey, P. B., Abdullaev, F. & Frenkel, G. D. (1991) Differential cytotoxicity of selenite for tumor cells can be achieved by differential depletion of cellular glutathione. FASEB. J
65 Shen, H. M., Yang, C. F. & Ong, C. N. (1999) Sodium selenite-induced oxidative stress and apoptosis in human hepatoma HepG(2) cells. Int. J. Cancer
66 Frenkel, G. D. & Falvey, D. (1989) Involvement of cellular sulfhydryl compounds in the inhibition of RNA synthesis by selenite. Biochem. Pharmacol.
67 Aronow L & Kerdel-Vega F (1963) Seleno-cystathionine, a pharmacologically active factor in the seeds of lecythis ollaria: cytotoxic and depilatory effects of extracts of lecithis ollaria. Nature.
68 Andrade EHA, JGS Maia, Streich R, Marx F (1999) Seed composition of amazonian lecythidaceae species: part 3 in the series “studies of edible amazonian plants. Journal of Food Composition and Analysis.
69 Palmer IS & Herr A (1982) Toxicity of selenium in brazil nuts to rats. Journal of Food Science.
70 Secor CL, Donald JL (1989) Variation in the Selenium Content of Individual Brazil Nuts. Carol L. Journal of Food Safety.
71 Chang JC, Gutenmann WH, Reid CM, Lisk DJ (1995) Selenium content of Brazil nuts from two geographic locations in Brazil. Chemosphere.
72 Vonderheide AP, Wrobel K, Kannamkumarath SS, B’Hymer C, Montes-Bayón M, Ponce De León C, Caruso JA (2002) Characterization of selenium species in Brazil nuts by HPLC-ICP-MS and ES-MS. J Agric Food Chem.
73 Pacheco AM, Scussel VM (2007) Selenium and aflatoxin levels in raw Brazil nuts from the Amazon basin. J Agric Food Chem.
74 Thomson CD, Chisholm A, McLachlan SK; Campbell JM (2008) Brazil nuts: an effective way to improve selenium status. Am J Clin Nutr.
75 Maranhão PA, Kraemer-Aguiar LG, de Oliveira CL, Kuschnir MC, Vieira YR, Souza MG, Koury JC, Boulskela E (2011) Brazil nuts intake improves lipid profile, oxidative stress and microvascular function in obese adolescents: a randomized controlled trial. Nutr Metab (Lond).

7 comments On Schadest du unbewusst deiner Schilddrüse?
Hallo,
obwohl dieser Artikel schon etwas älter ist, möchte ich gerne eine Frage loswerden.
Ich hatte meinen Selenwert im VOLLBLUT untersuchen lassen. Das Ergebnis war mit 88,8 ug/l nicht berauschend (Das Labor gibt einen Referenzbereich von 85 – 147 ug/l an).
Nun nehme ich aber durch ein Mulitvitamin täglich alle 3 Formen von Selen ein: Selen [als Se-Methyl L-Selenocystein, L-Selenomethionin (hefefrei) (SelenoPure), Natriumselenit].
Sollte ich weiterhin Selen in meinem Vollblutwert messen oder ist es eurer Meinung nach besser, in Zukunft meinen Selenspiegel im Vollblut UND Serum messen zu lassen?
Zum Abschluss noch ein großes Dankeschön für diesen großartigen Artikel und die bereitstellung neuer Ideen.
Alles Gute!
Und schon wieder ein threat der einen menschen nur mehr verzweifeln lässt.
Ich habe alle artikel auf dieser seite gelesen sie wiedersprechen sich jedesmal aufs neueste.
Am anfang hiess es Low carb nicht gut weil nur eintönig und man könnte davon insulin resistenz bekommen FRAGE: WAS SOLL EINER TUN DER SCHON DIABETES TYPE 2 HAT wie soll der sich verbessern wenn kh streichen nicht gut ist.
Dann lese ich auf der selben seite monate später paleo und low carb gut aber nicht so lange…
Leute entscheidet euch endlich auf eine ordentliche antwort
Es lesen hier nicht nur super athleten und bolts mit sondern auch kranke dicke menschen die vielleicht etwas ändern wollen.
Laufen nicht gut da nur glykose speicher entleert wird.
Muskel besser aber der braucht kh
Aber kh schlecht für type 2 da krank
Aber abend kh doch weil sonst eiweiss verzuckerung.
Und als ob das nicht genug wäre kommt jetzt hormone auch dazu.
Wie soll ein normal denkender lesender mensch sich da irgendwie zurecht finden.
Warte auf antwort……
Interessanter Kommentar. Interessant auch, dass nach dem Lesen aller Artikel auf dieser Seite (sind immerhin über 400) hängen bleibt, dass sich alles widerspricht.
Bitte beachte: Auf edubily wirst du nie eine bequeme und einfache Antwort erhalten. Sonst würde hier etwas schief laufen. Im Internet gibt es viele Seiten, wo man genau das nachlesen kann, was man sich wünscht.
Wer krank ist, sollte sich am besten in ärztliche Behandlung begeben.
Ok.
Genau das, was hier beschrieben ist, ist mein Problem. Durch Radikaldiät, „Mrs. Fitnessfreak“ leide ich unter dem Low-T3-Syndrom und nehme selbst mit 800 kcal zu .. Die Frage ist, was tut man in so einem Fall? Wenn ich sogar mit 800 kcal zunehme, wieso dann Kcal erhöhen? Nehme ich dann noch mehr zu? Oder doch nicht? Welche Medikation ist in diesem Fall die richtige? Es wäre super, wenn hier nicht nur die Symptome, sondern auch Lösungansätze beschrieben werden könnten..
Viele Grüße
Wenn Paranüsse zu „ungenau“ sind und man seine Blutwerte genau einstellen möchte, würde ich sogar zu einer Kombination aus beidem greifen. Allerdings Fokus auf Selenomethionin.
An dieser Stelle sollte man die verschiedene Aussagekraft der Blutwerte (eher Serum für Selenit vs Vollblut für Methionin) für die jeweilige Supplementierung beachten.
Wie gesagt: Ich esse lieber regelmäßig Paranüsse dafür
es bleibt für mich immer noch die Frage, welche Selenform (als NEM) die zu bevorzugende ist…Natriumselenit oder Selenmethionin? Es gibt hier widersprüchliche Aussagen, da Methionin wohl vermehrt in das Muskelprotein eingebaut wird und sich im Körper anreichern kann, wobei Na-Selenit bei Überschuss ausgeschieden wird