Du kannst dich sicher noch erinnern, dass wir im Buch sowohl den Mitochondrien-bauenden AMPK/PGC-1alpha-Signalweg besprochen haben, als auch den Muskel-bauenden Akt/mTOR-Signalweg.
Nur gesund durch Mitochondrien?
Wir können uns die zelluläre Genexpression in etwa so vorstellen: Auf der einen Seite des Spektrums finden wir AMPK/PGC-1alpha und auf der anderen Seite finden wir Akt/mTOR. Wir können durch alltägliche Umwelteinflüsse (z. B. Sport, Ernährung und Co.) diese Schalter anspringen lassen und so den kompletten Zellstoffwechsel beeinflussen.
Welche Resultate das mit sich bringt, haben wir hier im Blog, im Buch und andernorts (z. B. in den Guides) sehr ausführlich besprochen. Folgende Grafik fasst das Besprochene noch einmal zusammen.
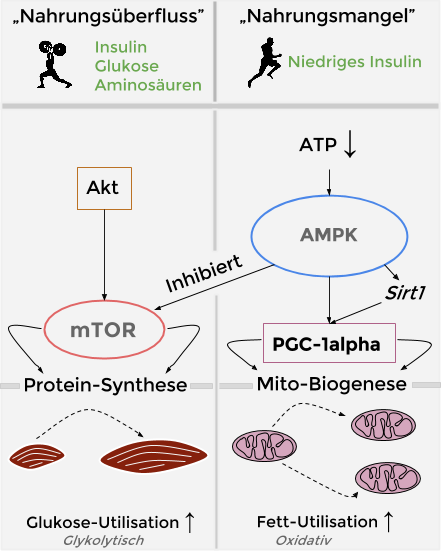
Unser Augenmerk lag dabei überwiegend auf dem AMPK/PGC-1alpha-Signalweg. Das liegt daran, dass die Literatur konstant von diesem Signalweg, ja, schwärmt. Alles erdenklich Gute (Langlebigkeit etc.) kommt von dort.
Ich glaube, das ist nur die halbe Wahrheit. Die andere Wahrheit konnte sich nie zeigen, da es schlicht niemanden interessierte. So ist das in der Wissenschaft.
Hypermuskulös, wenig Körperfett und gesund durch Anabolismus?
Schon im Handbuch bespreche ich Arbeiten, die zeigen: Aktivieren wir diesen anabolen Signalweg konstant, dann werden die Tiere wider Erwarten nicht krank. Ganz im Gegenteil. Bei denen wächst der Muskel unerhört. Doch: Was passiert als Folge?
Ein gutes Beispiel dafür sind transgene Mäuse1 Bei denen aktivieren Wissenschaftlicher schlicht künstlich dieses, eben (und im Buch) besprochene, Akt. Akt, ein Protein, wiederum aktiviert mTOR – der zentrale Schalter für Anabolismus. In der Sprache der Zelle: Protein-Synthese. Doch wie sehen die globalen, sprich systemischen Effekte aus?
Um das herauszufinden, mästeten die Forscher diese Mäuschen und aktivierten zeitgleich dieses Akt-Gen. (Logischerweise gab es auch eine normalgefütterte Kontrollgruppe und eine normalgefütterte Akt-Gruppe.) Die Resultate waren beeindruckend:
- Nach einigen Wochen erreicht die Akt-induzierte Muskel-Hypertrophie ein Plateau (Stichwort Myostatin)
- Bis dahin hatten die Mäuschen schon einen 100 % größeren Muskelquerschnitt und 50 % mehr Kraft
- Akt vergrößerte ausschließlich die großen Typ-II-Fasern
- Die Mäuschen hatten gegenüber der Mast-Kontrollgruppe fast 50 % weniger Körperfett, keine Blutzuckererhöhung, normale Insulin-Werte, niedrige Leptin-Werte und erhöhte Glukagon-Werte
- Während die Mast-Mäuschen schon typische Erscheinungen wie Fettleibigkeit, Fettleber und Insulinresistenz zeigten, wiesen die Akt-Mäuschen eine völlig normale Glukose-Toleranz auf und überhaupt keine Fettleber
- Der Muskel fischte bis zu doppelt so viel Traubenzucker (Glukose) aus dem Blut
- Trotz der Tatsache, dass die Muskel-Mäuschen sich 40 % weniger bewegten, hatten sie einen höheren Energieumsatz
- All die eben genannten Effekte konnten geblockt werden durch einen mTOR-Inhibitor
Klingt beeindruckend? Ist beeindruckend.
Trotz viel weniger muskulärer Fettverbrennung, sehr viel weniger Körperfett?
Insgesamt wurden 3500 Gene im Muskel entweder an- oder abgeschaltet.

Jetzt kommt der Punkt: Akt-Transgene-Muskeln schalteten Gene ab, die am Fettstoffwechsel beteiligt sind – wie: PGC-1alpha (75 % weniger) und Co. Gleichzeitig wurden Gene hochreguliert, die am Glukose-Stoffwechsel partizipieren. Der Muskel switchte weg von der Fettverbrennung, hin zum Glukose-Stoffwechsel. Interessant dabei ist, dass in der Leber genau das Gegenteil passierte. Dort fanden die Wissenschaftler aktive Gene, die für gesteigerte Fettsäureoxidation sorgen.
Hier also wird ein Dogma auf den Kopf gestellt. Der Muskel muss kein Fett verbrennen können und kann trotzdem systemisch dafür sorgen, dass die Tierchen völlig gesund bleiben und hypermuskulös.
Was hättest du gerne? Völlig egal, solange du Sport treibst!
Ganz offensichtlich müssen wir langsam aber sicher anerkennen, dass es völlig wurschd ist, in welche Richtung (Ausdauer vs. Kraftsport) wir unseren Muskel entwickeln – solange wir ihn entwickeln, wird er uns vor den vielen bösen Gefahren in unserer heutigen Welt schützen.
Interessant ist, dass es zur einen Seite des Extrems wohl das passende Pendant auf der anderen Seite gibt. So wissen wir neuerdings, dass das Fettgewebe nicht nur metabolisch aktiv wird durch Myokine, die vom AMPK/PGC-1alpha-Signalweg ausgehen (Irisin), sondern auch durch Myokine, die vom Akt/mTOR-Signalweg ausgehen (FGF21).
Mir gefällt ein großer, kräftiger Muskel, der mir konstant Glukose aus dem Blut fischt und sehr anabol ist. Das könnte Stoff für ein neues Handbuch werden :-) Mal sehen!
Was mich nun wirklich interessiert: Wie sehen die Langzeiteffekte aus, wenn man das Leben dieser hypermuskulösen Tierchen studiert? Werden die auch alt? Und wenn ja: wie? Spannend, spannend!
Literatur
- Yasuhiro Izumiya et al. „Fast/Glycolytic Muscle Fiber Growth Reduces Fat Mass and Improves Metabolic Parameters in Obese Mice“ In Cell Metab. 2008 Feb; 7(2): 159–172. DOI: 10.1016/j.cmet.2007.11.003.

6 comments On MTOR und AKT: Gesund durch Anabolismus
Die konstante Anschaltung von mTOR und Akt kann zu Krebs führen. Es wurde gezeigt, dass in Krebszellen Signaling pathways wie PDGF oder Ras konstant angeschaltet sind was zu einer erhöhten Akt Ausschüttung kommt. Akt ist nicht nur für mTOR zuständig sonder inhibiert Bad welches pro-apoptotisch wirkt. Stimmt schon, dass es zu Zellwachstum kommt aber ob man das immer möchte ist die Frage, da anti apoptotisch nie gut ist. (DNA damage, promotor methylation etc)
Wir reden ja vom Muskel …
Übrigens: „anti apoptotisch ist nie gut“ ist nicht richtig. Viele Möglichkeiten zur Regeneration schalten anti-apoptotische Signalwege ein. Wir denken in Zyklen und Kontext, nicht in „an oder aus“.
LG
Nahrungsüberfluss bei intensiven Training und Diät bei Ruhetagen bzw. Ruhewochen. Da gibt es unterschiedliche Meinungen, in welchem Rhythmus das am effektivsten ist (Rebound Effekt). Sind 3 Tage Training ein Tag Ruhe bzw. 3 Wochen Training und eine Woche Ruhe ein effektiver Rhythmus. Oder ist ein anderer effektiver. Ziel ist weniger Körperfett bei mehr Kraft und Ausdauer ohne Masse aufzubauen. Also maximal leicht mit viel Kraft und Ausdauer.
Super interessant danke für diesen Artikel
Hab bei J. Kruse gelesen, dass unter KH-Verbrennung mehr mitochondriales Elektronenleck gibt als bei Fett-Verbrennung.
Ich kopiere mal meine Notizen rein:
KH-Verbrennung im Krebszyklus: NADH:FADH2 ratio von 5:1.
Fettverbrennung, Beta-Oxidation: NADH:FADH2 ratio von 3:1 (je nach Länge der Fettsäure).
„“During oxidative phosphorylation, almost all of the reducing
equivalents produced by glucose metabolism in the Krebs cycle are in the
form of NADH with the exception of the succinate dehydrogenase step,
which takes place in mitochondrial complex II and makes FADH2.
Metabolism of one molecule of glucose produces an NADH:FADH2 ratio of
5:1 whereas fatty acid metabolism in beta oxidation and the Krebs cycle
will produce a ratio of 5:3:1 depending on the length of the fatty acid.“
Mehr Fettverbrennung soll weniger Alterung bedeuten.
Kann das selber aber noch nicht bewerten.
Besten Gruß, Erik
Na ja, die Annahme ist ja, dass es Elektronen-Leaks gibt am NADH-Dehydrogenase-Komplex (K. I) gibt, s. g. reverse electron flow.
Abgesehen davon, dass das so noch gar nicht eindeutig belegt ist, würde ich mich auf die Effizienz konzentrieren und die ist bei KH-Oxidation deutlich höher, es wird schlicht weniger Uncoupling betrieben, was im Grunde auch dafür spricht, dass weniger Superoxid-Radikale (von denen Kruse immer schwärmt) entstehen, die für Uncoupling und somit mitochondriale Ineffizienz sorgen.
Aber darum geht es nicht.
Grundsätzlich wird eine Muskelzelle, die KH-Oxidation hochschraubt, eher in Richtung anaerober Stoffwechsel switchen, ansonsten bestünde kein Grund, überhaupt die Glykolyse, sprich den KH-Abbau einzuleiten. Sprich: Eine vermehrte KH-Oxidation wird sowieso eher Mitochondrien-unabhängiger oder zumindest nicht mehr so Mitochondrien-lastig laufen.
Daher erübrigt sich auch diese Sache.
Zumal es sowieso gewebespezifische Unterschiede gibt. Muskulatur ist am Ende nicht das, was langlebig macht – eher Leber, Gehirn und Co.
Wir hier besprechen ja nur den muskulären Energiestoffwechsel, der zwar auch eine Rolle spielt, aber eher systemisch betrachtet im Hinblick auf eine mögliche metabolische Entgleisung, wie im Alter zu sehen.
LG, Chris