In diesem Text, so scheint es, werfe ich mal wieder mit Fachwörtern um mich. Ab einer gewissen „Stufe“ lässt sich das einfach nicht vermeiden, da ich der Einfachheit halber inhaltliche Schwächen akzeptieren müsste. Das liegt nicht in deinem und auch nicht in meinem Sinne :-)
Aber: Zum einen bist du sicher schon erfahrener edubily-Leser und zum anderen kann man diesen Text gut verstehen, wenn man sich selbst die Zeit gibt, gründlich zu lesen (und zu verstehen!).
Was ist eine Fettleber?
Eine Fettleber entwickelt sich aus einem Ungleichgewicht zwischen Fettsäure-Anreicherung und Fettsäure-Oxidation. Daraus ergibt sich eine positive Fettsäure-Balance. Diese Fettsäure-Anreicherung induziert langfristig nicht nur eine hepatische Insulinresistenz (also eine IR in der Leber), sondern auch eine Entzündungsreaktion, die sich zu Gewebenekrosen (= Gewebeschäden) ausweiten kann – bis hin zur Zirrhose.
Wieso spielt Fettleber eine Rolle für mich?
Das hat einen einfachen Grund: Es ist nicht schlimm, wenn der Muskel keine Glukose mehr verarbeiten kann. Es wäre aber wünschenswert. Allerdings ist der Super-Gau, bezogen auf eine metabolische Entgleisung, erst dann erreicht, wenn auch die Leber dichtmacht und keine Glukose mehr aufnimmt. Erst dann steigt der Blutzucker-Wert deutlich an.
Welche Symptome gibt es?
Die schlechte Nachricht: Zunächst leider keine. Bevor die Leber deutliche Schäden nimmt, sind erste Warnhinweise:
- hoher VLDL-Output
- hoher Triglycerid-Wert
- im Verlauf: erhöhte Leberwerte
- im Verlauf: schlechter Langzeitblutzucker (HbA1c)
Entstehung und Ursachen einer Fettleber
Der Pathomechanismus ist einfach erklärt.
Eine Fettleber speist sich aus zwei Quellen:
- Freie Fettsäuren
- Fettsäuren aus der DNL (= De-Novo-Lipogenese)
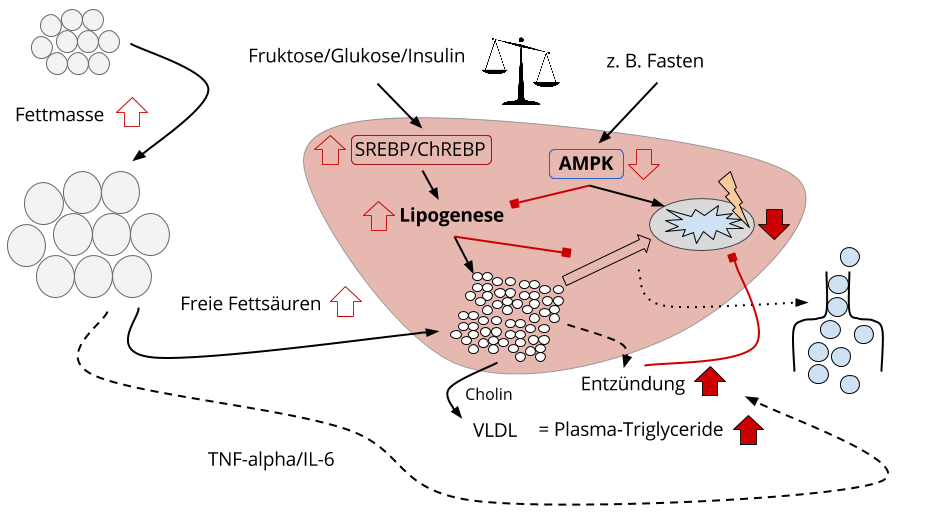
Abbildung 1: Pathomechanismus Fettleber. Freie Fettsäuren lagern sich als Lipidtröpfchen in der Leber ein, sofern nicht oxidiert. Fruktose, Glukose und Insulin können, wenn chronisch erhöht, die Lipogenese (Fettneubildung aus Kohlenhydraten) induzieren – das geschieht durch die Aktivierung der „Zellschalter“ SREBP und ChREBP. Zeitgleich wird die Fettsäure-Oxidation durch die Lipogenese inhibiert. Der zentrale Stoffwechselschalter AMPK steigert Fettsäure-Oxidation und hemmt zeitgleich die Lipogenese. Ergibt sich ein energetisches Ungleichgewicht, bleibt AMPK inaktiv(er), was die Fettsäure-Oxidation einschränkt. Lipide und Lipid-Derivate wirken toxisch, es entstehen oxidativer Stress und Entzündungen. Diese werden durch die systematische Entzündungsreaktion, ausgehend vom Viszeralfett, unterstützt und verschlechtern die Gesundheit der Leberzellen, induzieren eine mitochondriale Dysfunktion. Fette können die Leber via VLDL verlassen, was durch Cholin ermöglicht wird.

Abbildung 2: Legende
Fettmasse steigt, freie Fettsäuren (im Blut) steigen
Wie in der Schema-Zeichnung angedeutet, gibt die wachsende Fettmasse, proportional zur Größe, (freie) Fettsäuren in den Blutstrom ab.
Das Tückische dabei ist, dass die Fettmasse per se nicht eine derart große Rolle spielt, wie wir das gemeinhin annehmen.
Der Ort der Fettlagerung ist entscheidend
Die Fettdistribution, also der Ort der Fettlagerung, ist viel wichtiger: Viszeralfett ist hinsichtlich der unregulierten Fettsäure-Freisetzung (genannt Lipolyse) deutlich aktiver.
Viszeralfett ist das Fett, das in der Bauchhöhle sitzt und den Bauch von innen heraus nach außen wölbt.
Die DNL spielt eine Rolle, aber nicht die Rolle
Ich möchte klar zum Ausdruck bringen: Entgegen der im Internet vorherrschenden Meinung sind sich Wissenschaftler einig, dass die meiste Fettsäurelast nicht von der DNL ausgeht, sondern von dem gerade beschriebenen Überangebot freier Fettsäuren. Tatsächlich hat man das bereits sehr genau untersucht: Circa 60 % der Leber-Fette waren ursprünglich freie Fettsäuren (das heißt: kommen aus dem Fettgewebe). Gleichzeitig findet man bei Patienten mit nicht-alkoholischer Fettleber eine erhöhte Konzentration freier Fettsäuren im Plasma. Denn: Tatsächlich ist es – bei chronisch gesteigerter Konzentration freier Fettsäuren – „einfach, eine Fett-Akkumulation in der Leber [zu induzieren]“.
Damit die DNL eine Rolle spielen kann, muss die periphere Insulinsensitivität eingeschränkt sein
Es leuchtet im Prinzip auch ein: Damit der Blutglukose-Wert chronisch erhöht ist (und sich eine stark gesteigerte Lipogenese ergeben kann), reicht es nicht, sich ausschließlich von Kohlenhydraten zu ernähren. Denn: Steigert man die Kohlenhydratzufuhr (und isst somit reziprok weniger Fett), so wird bei Gesunden die Insulinsensitivität besser, was weniger Insulin benötigt. Gleichzeitig steigern extrahepatische Gewebe (außerhalb der Leber), zum Beispiel der Muskel, die Expression von Glukose-verarbeitenden Enzymen, weswegen diese Gewebe deutlich mehr Glukose oxidieren.
Ich wiederhole: Dies ist bei (metabolisch) Gesunden der Fall und liegt im Sinne einer metabolischen Flexibilität und Adaptationsfähigkeit des menschlichen Organismus.
Eine hohe Fettmasse und/oder eine zu aktive Fettmasse sorgt für eine systematische Anreicherung von Fettsäuren in den Organen
Steigt allerdings die Fettmasse, wie oben beschrieben, dann lagern sich zirkulierende Fettsäuren nicht nur in der Leber, sondern auch in anderen Organen ein.
Diese Fettsäuren blockieren das Insulinsignal und konkurrieren darüber hinaus mit Glukose um die Oxidation.
Nun: In diesem Falle sprechen wir von Insulinresistenz.
Anmerkung: Eine Insulinresistenz (z. B. im Muskel) kann auch durch systematische Entzündungen hervorgerufen oder verstärkt werden. Dazu gleich mehr.
Insulinresistenz lässt den Blutzucker-Wert und die Insulin-Konzentration ansteigen. Folge: „DNL“
Als Folge steigt der Blutglukose-Wert chronisch an, gleichzeitig auch der Insulinwert.
Die Fettsäure-Balance (in der Leber) wird positiver, dadurch, dass nun zusätzlich eine Lipogenese eingeleitet wird: Insulin, Glukose und Fruktose (zusammen ≙ Zucker; Saccharose). Diese machen „Zellschalter“ namens ChREBP und SREBP aktiv und aktivieren somit Gene, die Enzyme der Lipogenese bilden.
Die Lipogenese beeinträchtigt die hepatische Fettsäure-Oxidation
Die Leber erleidet einen Energieüberschuss, was die AMPK-Aktivität senkt. AMPK reguliert positiv die Fettverbrennung (ß-Oxidation), die mitochondriale Gesundheit und hemmt normalerweise Enzyme der Lipogenese.
Vereinfacht ausgedrückt, kann der Lipogenese-Prozess die Fettverbrennung unterdrücken. Nicht nur, weil in diesem Milieu eine niedrigere AMPK-Aktivität zu beobachten ist, sondern auch, weil eine Substanz namens Malonyl-CoA, den Fettsäure-Transport in die Mitochondrien hemmt (via Inhibition der CPT).
Die Aufnahme und Oxidation von Fetten kann man sich also als eine Art Flaschenhals (siehe Grafik, rechts) vorstellen, den man weiten oder verengen kann.
Insgesamt: Zu viele Fettsäuren, zu wenig Oxidation
Es entsteht nun ein Ungleichgewicht zwischen der Anreicherung intrazellulärer Lipide (= potenzielle Energie) und Oxidation (= tatsächlicher Verbrauch) derselben.
Folgen: Entzündungsreaktion, Gewebeschäden und mitochondriale Dysfunktion
Dieses Milieu erzeugt langfristig oxidativen Stress und Zellschäden, was eine Entzündungsreaktion provoziert. Diese Entzündungsreaktion zeigt sich in Form von Botenstoffen wie IL-6 (Interleukin-6) und TNF-alpha.
Dieser oxidative Stress (inklusive Entzündungsreaktion) interferiert mit der mitochondrialen Gesundheit. Mitochondrien zeigen nunmehr eine eingeschränkte Fähigkeit zur Oxidation von Fettsäuren und zur allgemeinen Energiegewinnung (in Form von ATP), was die Zellgesundheit weiter verschlechtert.
Anmerkung: Eine systematische Entzündungsreaktion kann auch dem Viszeralfett entspringen, das sich mit zunehmender Größe entzündet. Dies beeinflusst bzw. verstärkt nicht nur die muskuläre Insulinresistenz, sondern beeinflusst bzw. verstärkt auch die Abwärtsspirale in der Leber. Außerdem: Zeigen Mitochondrien eine Dysfunktion, aus welchen Gründen auch immer, kann das eine Fettleber nicht nur begünstigen, sondern sogar selbst hervorrufen.
Überschüssiges Fett verlässt die Leber via VLDL
(Überschüssiges) Leberfett kann die Leber verlassen via VLDL (ein Lipoprotein), das das Fett via Blut zum Fettgewebe transportiert. Dazu ist der Mikronährstoff Cholin nötig (siehe Grafik).
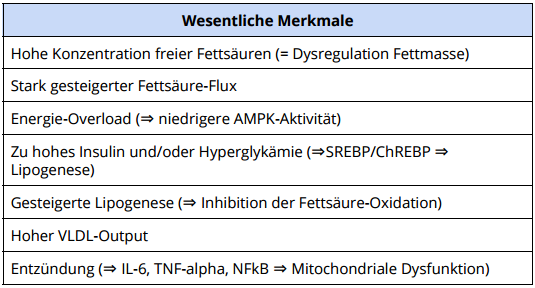
Zusammenfassung: Wesentliche Merkmale der Pathogenese
Ist Fruktose schuld?
Meiner Meinung nach: nein.
Das „Problem“ bei Fruktose: Es wird – im Vergleich zu Glukose – zwar eher verstoffwechselt als Fett, hemmt allerdings die Oxidation desselben via Einleitung der Lipogenese.
Während es im Labor, in-vitro und im Biochemie-Buch sicher richtig ist, sehe ich keine bis wenig Relevanz für das wahre Leben. Zumindest bei Gesunden.
Denn im Grunde ist es nicht nur eine Frage nach „Fruktose rein, Fett raus“, sondern auch eine Frage nach der Energiebalance in der Leber.
Denn: Wie wir gelernt haben, ist der zentrale Schalter, das AMPK, unter regulatorischer Kontrolle der Energiebalance. Sollte sich akut eine negative Energiebalance ergeben, was unter Frei-Leben-Bedingungen (= isokalorischen Verhältnissen) der Fall ist, ist eine gesteigerte Lipogenese zwar denkbar, aber nicht so deutlich, als sich daraus eine Fettleber-Entwicklung ergeben könnte.
Man sollte schlicht auf natürliche Fruktose-Lieferanten zurückgreifen (z. B. Früchte), die natürliche Begleitstoffe haben, die Stoffwechselwege ebenfalls modulieren. Zu nennen wären sekundäre Pflanzenstoffe wie Polyphenole.
Wie grundverschieden entsprechend die metabolische Wirkung sein kann, kann man sehr gut anhand des fruktosereichen Honigs studieren, der völlig anders wirkt als eine isolierte, isokalorische Fruktose-Menge.
Die Rolle des Glukagons
Leider konnte ich die Rolle des Glukagons aus Platzgründen nicht grafisch illustrieren.
Glukagon ist der Gegenspieler von Insulin und wird immer dann produziert, wenn der Blutzucker-Wert im Blut absackt. Das passiert beispielsweise bei periodic undereating (siehe unten).
Glukagon erhöht die Konzentration eines Stoffes namens cAMP – dieses cAMP hemmt die Lipogenese und steigert die Fettverbrennung, indem es AMPK aktiviert.
Daher: Viel Glukagon = wenig Leberfett.
Und was hat Leber-Insulinresistenz nun mit Fettleber zu tun?
Ganz einfach: Eine Insulinresistenz, in der Leber, entsteht dann, wenn die gespeicherten Fette (plus Derivate) das Insulin-Signal blockieren. Im Blog findest du massig Information zum Thema Insulinresistenz und wie sie – zellulär betrachtet – entsteht.
Diese Leber-Insulinresistenz wird zusätzlich verstärkt durch die entstehende Entzündungsreaktion.
Und ich wiederhole mich: Macht die Leber dicht, gibt’s den metabolischen Super-Gau und der Arzt guckt böse!
Nie war es einfacher, eine Fettleber zu heilen
Einfach umsetzbare Möglichkeiten
Zuerst ein paar Ratschläge, die sich alleine aus der oben angeführten Grafik (plus Erklärung) ergeben:
- Verliere (Viszeral-)Fett
Nichts ist leichter als das! Viszeralfett ist das erste Fett, das verschwindet bei guten Ernährungsformen. Idealerweise senkst du vorübergehend den Kohlenhydrat-Anteil deiner Ernährung. Das heißt nicht, dass du entsprechend mehr Fett essen sollst. Denn du bedienst dich am besten am Fettspeicher der Leber (und des Viszeralfetts).
- Streiche raffinierte Zucker (insb. Saccharose und Fruktose)
Müssen Gesunde nicht zwangsläufig. Ich gehe nämlich davon aus, dass meine Leser ein Grundverständnis von gesunder Ernährung haben. Aber: Ist die Leber fett, muss man nicht auch noch bewusst lipogene, isolierte Substrate zuführen.
- Integriere Fastenperioden oder praktiziere ein periodic undereating
Wir haben bereits eine nette Artikel-Reihe zu diesem Thema. Was du damit erreichst? Eine negative Energiebalance in der Leber (daraus folgt: AMPK-Aktivität; siehe Grafik).
- Sorge für eine ausreichende Cholin-Verfügbarkeit, supplementiere gegebenenfalls
Bei mir im Regal steht immer diese kleine Dose, die Cholin und Inositol enthält. Das brauchst du nicht, wenn du täglich > 5 Eier isst oder – wie von uns empfohlen – deinen Körper mit 12 g Soja-Lecithin versorgst.
Möglichkeiten für Fortgeschrittene (= Biochemie-Liebhaber)
Die folgenden Möglichkeiten sollten eigentlich auf jeder Liste stehen. Allerdings sollte man zunächst die gerade erläuterten Grundlagen praktizieren – versteht sich von selbst, oder?
- Konsumiere 3-5 g Omega-3-Fettsäuren (DHA & EPA)
DHA und EPA sind Wunderwaffen. Warum? Sie modulieren nicht nur einen Aspekt, sondern diverse Aspekte.
DHA/EPA inaktiveren ChREBP und SREBP (siehe Grafik), weswegen die Lipogenese unterdrückt wird. Darüber hinaus helfen sie, die Fettverbrennung (mild) anzukurbeln.
Verlassen die Triglyceride die Leber, müssen die irgendwo unterkommen. Fischöl scheint das Enzym LPL zu regulieren – im Muskel, im Herz und im Fettgewebe, weswegen die Blutfette einfach geklärt werden, im Menschen: halbiert.
Außerdem sind DHA und EPA sehr potente Entzündungshemmer, was die Insulinsensitivität und die Stoffwechselfunktion der Leber verbessern wird, eventuell gar verhindert, dass Gewebe-Nekrosen entstehen.
Die beste Variante: Das Verspeisen von Heringen oder anderen kleinen Fettfischen.
- Sorge für eine ausreichende Stickstoffmonoxid- bzw. Nitrat-Konzentration
[…] Man sieht sehr deutlich, dass sich diverse Stoffwechsel-Dysfunktionen daraus ergeben: Eine nahezu doppelt so hohe Insulin- und Glukose-Konzentration, einhergehend mit einer deutlich schlechteren Insulin-Sensitivität, gemessen anhand des IR-Index. Auch die Triglycerid-Werte schießen in die Höhe. Diese Veränderungen können alle alleine dadurch blockiert werden, dass man das Enzym Arginase hemmt, das im Zuge der metabolischen Entgleisung eine gesteigerte Expression erfährt. (Auszug aus unserem NO-Guide.)
Die Rede ist vom metabolischen Syndrom inkl. Fettleber: Diese Anomalien entstehen erst dann, wenn die NO-Konzentration fällt, da vermehrt Arginase gebildet wird, das Arginin abbaut.
Tatsächlich ist der NO-Abfall ein sehr frühes Merkmal der Fettleber-Entwicklung und verschlechtert die Stoffwechselgesundheit der Leber massiv.
Alles, was es zu diesem Thema derzeit zu wissen gibt, haben wir für dich aufgearbeitet.
Geheimtipp: 5-MTHF, 5-Methyltetrahydrofolat.
- Steigere deine GLP-1-Konzentration
GLP-1 ist ein Darmhormon, das bei metabolisch Kranken leider zu wenig produziert wird.
Die Aufgabe des Hormons ist simpel: Die Wirkung von Insulin potenzieren, so dass weniger Insulin benötigt wird.
GLP-1 hemmt so die Entstehung einer Insulinresistenz, aktiviert selbst die Fettverbrennung der Leber und deaktiviert die Lipogenese ebenda.
Kurzum: Eine möglichst hohe GLP-1-Konzentration ist sehr wünschenswert.
Wie du das machst, haben wir dir hier schon einmal hingeschrieben.
Auch: Stichwort Glycin.
Anmerkung: Vor ein paar Tagen wurde eine Arbeit veröffentlicht, die zeigte, dass man eine Fettleber spielend leicht rückgängig machen kann durch die Zufuhr von nicht-essentiellen Aminosäuren. Meines Erachtens scheint Glycin hier eine Schlüsselrolle einzunehmen. Das legen diverse Arbeiten nahe (siehe dazu z. B.: McCarty, 2014). Willst du also viel Glycin und andere nicht-essentielle Aminosäuren, greife doch einfach zu 20-30 g Kollagen-Hydrolysat. Deine Leber wird’s dir danken. By the way: Diese Arbeit kam von der Wissenschaftlerin Ina Bergheim, Uni Jena. Unser Autor Simme lernt quasi bei dieser Frau.
- Senke deinen Ferritin-Wert
Eisen hat massiven Einfluss auf diverse Stoffwechselparameter. Eine Eisen-Restriktion (ohne Anämie) verbessert den Glukose-Stoffwechsel dramatisch und hemmt die Entstehung von Diabetes (da sie die ß-Zellfunktion der Bauchspeicheldrüse schützt). Umgekehrt kann ein „Eisen-Laden“ nicht nur den Glukose-, sondern auch die Fett-Stoffwechsel (via LPL) einschränken. Gleichzeitig kann man damit eine Insulinresistenz induzieren. Vermutlich weil zu viel Eisen die Entstehung von oxidativem Stress fördert (Implikationen: siehe Verlauf).
Wie tief ist zu tief und wie hoch ist zu hoch? Einige von euch glauben, sie fahren besonders gut mit Werten um die 300 – 400 ng/ml. Eher nicht. Alles bis 100 ist okay, besser: um die 80 ng/ml.
Bedenke: Das meiste Eisen lagert im Hämoglobin. Steigt der Ferritin-Wert also an, sind alle Eisen-Systeme bereits maximal abgesättigt. Dazu zählt auch das geschätzte Myoglobin und die eisenhaltigen Enzyme wie Cytochrome.
Wie senkt man nun diesen Wert? Eisen-Restriktion (= kein rotes Fleisch) und/oder Blutspende. Letztere Intervention geht schneller.
Schlussworte
Wie du gelernt hast, lässt sich eine Fettleber sehr einfach positiv verändern. Soll heißen: Du bist deinem Schicksal nicht ausgeliefert.
Die potentesten Möglichkeiten haben wir dir hier aufgelistet.
Es gibt durchaus noch andere Möglichkeiten (z. B. natürliche AMPK-Aktivatoren), allerdings solltest du mit diesen Interventionen bereits durchschlagenden Erfolg haben.
Du weißt nun:
- Warum du deine Leber „sauber“ halten solltest
- Woran du frühzeitig erkennen kannst, dass du säubern musst
- Wie sie überhaupt entsteht
- Welche Möglichkeiten es gibt, die Leber zu säubern
Referenzen
Ben-Shlomo, Shani; Zvibel, Isabel; Shnell, Mati u. a. (2011): „Glucagon-like peptide-1 reduces hepatic lipogenesis via activation of AMP-activated protein kinase“. In: Journal of Hepatology. 54 (6), S. 1214-1223, DOI: 10.1016/j.jhep.2010.09.032.
Bradbury, M. W. (2006): „Lipid Metabolism and Liver Inflammation. I. Hepatic fatty acid uptake: possible role in steatosis“. In: AJP: Gastrointestinal and Liver Physiology. 290 (2), S. G194-G198, DOI: 10.1152/ajpgi.00413.2005.
Choi, Joo Sun; Koh, In-Uk; Lee, Hyo Jung u. a. (2013): „Effects of excess dietary iron and fat on glucose and lipid metabolism“. In: The Journal of Nutritional Biochemistry. 24 (9), S. 1634-1644, DOI: 10.1016/j.jnutbio.2013.02.004.
Cooksey, R. C.; Jones, D.; Gabrielsen, S. u. a. (2010): „Dietary iron restriction or iron chelation protects from diabetes and loss of -cell function in the obese (ob/ob lep-/-) mouse“. In: AJP: Endocrinology and Metabolism. 298 (6), S. E1236-E1243, DOI: 10.1152/ajpendo.00022.2010.
Czaja, Mark J. (2010): „JNK regulation of hepatic manifestations of the metabolic syndrome“. In: Trends in Endocrinology & Metabolism. 21 (12), S. 707-713, DOI: 10.1016/j.tem.2010.08.010.
Dekker, M. J.; Su, Q.; Baker, C. u. a. (2010): „Fructose: a highly lipogenic nutrient implicated in insulin resistance, hepatic steatosis, and the metabolic syndrome“. In: AJP: Endocrinology and Metabolism. 299 (5), S. E685-E694, DOI: 10.1152/ajpendo.00283.2010.
Dongiovanni, P.; Ruscica, M.; Benedan, L. u. a. (2011): „F-17 Dietary iron overload induces visceral adipose tissue insulin resistance and hyper-resistinemia, and synergizes with obesity and fatty liver in inducing systemic insulin resistance“. In: Digestive and Liver Disease. 43 , S. S97, DOI: 10.1016/s1590-8658(11)60102-3.
Fargion, Silvia et al. „Hyperferritinemia, iron overload, and multiple metabolic alterations identify patients at risk for nonalcoholic steatohepatitis.“ The American journal of gastroenterology 96.8 (2001): 24482455.
Farrell, Peter A, John L Beard, and Marlin Druckenmiller. „Increased insulin sensitivity in irondeficient rats.“ The Journal of nutrition 118.9 (1988): 11041109.
Fernández-Real, José Manuel, Abel LópezBermejo, and Wifredo Ricart. „Crosstalk between iron metabolism and diabetes.“ Diabetes 51.8 (2002): 23482354.
Gabrielsen, J Scott et al. „Adipocyte iron regulates adiponectin and insulin sensitivity.“ The Journal of clinical investigation 122.10 (2012): 3529.
Jump, Donald B (2008): „N-3 polyunsaturated fatty acid regulation of hepatic gene transcription“. In: Current Opinion in Lipidology. 19 (3), S. 242-247, DOI: 10.1097/mol.0b013e3282ffaf6a.
Kim, Jonghan et al. „Iron loading impairs lipoprotein lipase activity and promotes hypertriglyceridemia.“ The FASEB Journal 27.4 (2013): 16571663.
McCarty, M. F.; DiNicolantonio, J. J. (2014): „The cardiometabolic benefits of glycine: Is glycine an ‚antidote‘ to dietary fructose?“. In: Open Heart. 1 (1), S. e000103-e000103, DOI: 10.1136/openhrt-2014-000103.
McKenney, James M; Sica, Domenic (2007): „Role of Prescription Omega-3 Fatty Acids in the Treatment of Hypertriglyceridemia“. In: Pharmacotherapy. 27 (5), S. 715-728, DOI: 10.1592/phco.27.5.715.
Michalk, Chris et al. “Arginin, Citrullin, NO – Alles, was du wissen musst.” Website: edubily.de (2015).
Minamiyama, Yukiko et al. „Iron restriction improves type 2 diabetes mellitus in Otsuka LongEvans Tokushima fatty rats.“ American Journal of PhysiologyEndocrinology and Metabolism 298.6 (2010): E1140E1149.
Parker, Helen M.; Johnson, Nathan A.; Burdon, Catriona A. u. a. (2012): „Omega-3 supplementation and non-alcoholic fatty liver disease: A systematic review and meta-analysis“. In: Journal of Hepatology. 56 (4), S. 944-951, DOI: 10.1016/j.jhep.2011.08.018.
Piperno, Alberto et al. „Increased serum ferritin is common in men with essential hypertension.“ Journal of hypertension 20.8 (2002): 15131518.
Perry, Rachel J.; Samuel, Varman T.; Petersen, Kitt F. u. a. (2014): „The role of hepatic lipids in hepatic insulin resistance and type 2 diabetes“. In: Nature. 510 (7503), S. 84-91, DOI: 10.1038/nature13478.
Shim, Jae-Jun (2012): „Body iron, serum ferritin, and nonalcoholic fatty liver disease“. In:The Korean Journal of Hepatology. 18 (1), S. 105, DOI: 10.3350/kjhep.2012.18.1.105.
Tirosh, Oren; Ilan, Erez; Budick-Harmelin, Noga u. a. (2009): „Downregulation of eNOS in a nutritional model of fatty liver“. In: e-SPEN, the European e-Journal of Clinical Nutrition and Metabolism. 4 (2), S. e101-e104, DOI: 10.1016/j.eclnm.2009.02.001.
Valenti, Luca et al. „Iron depletion by phlebotomy improves insulin resistance in patients with nonalcoholic fatty liver disease and hyperferritinemia: evidence from a casecontrol study.“ The American journal of gastroenterology 102.6 (2007): 12511258.
Vega, Gloria Lena et al. „Effects of N-3 fatty acids on hepatic triglyceride content in humans.“ Journal of Investigative Medicine 56.5 (2008): 780-785.
Viollet, Benoit; Foretz, Marc; Guigas, Bruno u. a. (2006): „Activation of AMP-activated protein kinase in the liver: a new strategy for the management of metabolic hepatic disorders“. In: The Journal of Physiology. 574 (1), S. 41-53, DOI: 10.1113/jphysiol.2006.108506.
Wei, Yongzhong (2008): „Nonalcoholic fatty liver disease and mitochondrial dysfunction“. In: World Journal of Gastroenterology. 14 (2), S. 193, DOI: 10.3748/wjg.14.193.
Wrede, CE et al. „Association between serum ferritin and the insulin resistance syndrome in a representative population.“ European Journal of Endocrinology 154.2 (2006): 333340.
6 comments On Fettleber heilen – Wie sie entsteht und was du dagegen tun kannst
Ich feier euren Blog und eure Infos. Mehr davon!!!
Super fundiert, einfach und auf den Punkt gebracht.
Hier wurde außerdem vergessen, Vitamin C heilt eine Fettleber, blockiert weitere Vernarbungen, senkt LDL, Lipoprotein a und Trygliceride. In Kombination mit OPC ist es noch effektiver.
Hallo,
nur wenn Ferritin + CRP (Entzündungswert) erhöht sind, deutet es auf ein Tumor hin!
Eisen (Ferritin) ist wichtig für den Stoffwechsel!
Hi Jörg,
danke dir.
Zu deiner ersten Frage: Das haben wir im Guide beantwortet.
Kurz: Wir wollen zunächst einmal versuchen, das eNOS-Enzym zu optimieren, bevor wir viel Citrullin „durchjagen“.
Zu Ferritin: Darauf habe ich leider keine eindeutige Antwort. Es kann sein, dass im Zuge einer metabolischen Entgleisung, auch der Eisen-Stoffwechsel durcheinander gerät.
LG, Chris
Hier habe ich eine mögliche Erklärung gefunden: https://www.grossesblutbild.de/ferritin-blutwert-zu-hoch-oder-niedrig.html
Bei länger bestehenden chronischen Entzündungen kann der Ferritin-Blutwert infolge einer Anämie erhöht sein. Man bezeichnet diese als Anämie bei chronischer Erkrankung. Auch hier ist genügen Eisen im Eisenspeicher vorhanden, es wird jedoch nicht in Hämoglobin und Retikulozyten eingebaut, sodass eine Blutarmut resultiert.
Ursache sind auch hier Fehlregulationen des Eisenhaushaltes durch das zentrale Hepcidin. Die Entzündungsreaktionen sorgen für dessen verstärkte Bildung in der Leber. Dadurch wird das Transporteisen Transferrin herunterreguliert und das Speichereisen Ferritin hochreguliert. Ebenso verringert Hepcidin die Eisenresorption im Zwölffingerdarm.
Hintergrund ist vermutlich, dass auch Mikroorganismen auf Eisen angewiesen sind. Durch die künstliche Verknappung sollen Krankheitserreger an einer weiteren Vermehrung gehindert werden.
Spannender Artikel Chris. Zwei kurze Verstädnisfragen hätte ich. Warum 5-MTHF und nicht Citrullin? Und woher kommen die hohen Ferritinwerte (wenn man sie denn hat) – allein vom roten Fleisch oder eine Folge von zuviel Fett?
Viele Grüße
Jörg