Kein anderes Thema beeindruckt mich in den letzten Wochen derart.
Über Insulin-Sensitivität haben wir wahrlich oft gesprochen. Es gibt sehr viele Möglichkeiten – Möglichkeiten, warum Insulin-Resistenz entsteht und Möglichkeiten, diese umzukehren, wieder normal auf das Hormon Insulin zu reagieren und, ganz wichtig, „Kohlenhydrate zu vertragen“.
In ein besonderes Licht rückte dabei Eisen in den letzten Wochen.
Eisen ist wahrlich ein besonderes Atömchen. In vielerlei Hinsicht.
Wir müssen den Eisen-Stoffwechsel studieren
Doch wollen wir zügig zum Punkt kommen.
Wir haben bereits vor Monaten über die Eisen-Wirkung berichtet: in unserem Trainingsguide. Auch in den letzten Wochen ist ein Artikel zum Thema Eisen in Relation zur Insulin-Sensitivität bei uns erschienen. Wie es mir scheint, wurde darüber im deutschen Internet noch nicht publiziert. Meine Meinung: Es wird Zeit.
Vor mir liegt eine beeindruckende Arbeit, die mir persönlich aufzeigt, dass die vielen Hinweise und Vermutungen stimmen.
Man könnte es in etwa so formulieren:
Eisen reguliert die Fähigkeit, auf das Hormon Insulin anzusprechen, entsprechend die Fähigkeit, Glukose aufzunehmen und als Substrat zu oxidieren.
Kommen wir zur Arbeit. Was wurde dort gemacht? Es ist schlicht eine Beweisführung der besonderen Art, weil die Wissenschaftler sehr willig waren, diverse Experimente (nicht nur eins) durchzuführen. Aber nun los:
HIF-1α reguliert Glukose-Stoffwechsel
Zunächst einmal das übliche Prozedere. Eine Leber-Zelle eines Tieres wird untersucht. Die Forscher nutzten einen Eisen-Chelator (Substanz, die Eisen bindet und unbrauchbar macht), um der Zelle freies Eisen zu rauben. Es wurden einige Experimente durchgeführt, die zu folgendem Schluss kamen:
Die Zelle bildete nicht nur mehr Insulin-Rezeptoren-RNA (Vorstufen des Proteins), sondern auch mehr Glut1-Transporter, Glukose-Transporter.
Dies ging einher mit einer deutlichen Erhöhung des HIF-1α, dem hypoxia-inducible factor.
Reden wir zunächst über diesen Hypoxie-Faktor: Das ist ein Protein, das aktiv wird, wenn, relativ betrachtet, der Sauerstoffgehalt der Zellen abnimmt. Das klingt alles andere als toll, ist aber wichtig: So spielt HIF-1α eine wesentliche Rolle bei der Sport-induzierten zellulären Anpassung, aber auch, ganz modern, bei dem Glukose-Sensing der ß-Zellen der Bauchspeicheldrüse. In anderen Worten: HIF-1α muss vorhanden sein, sodass die Bauchspeicheldrüse überhaupt erkennt, dass sie Insulin produzieren soll. Nun scheint es so, als ob HIF-1α durch die Eisen-Konzentration reguliert wird. Ergibt Sinn, da Eisen für gewöhnlich Sauerstoff bindet und so der Zelle als Marker dient. Tatsächlich wird HIF-1α destabilisiert durch Eisen und Sauerstoff, im Umkehrschluss stabilisiert durch einen relativen Konzentrationsabfall einer der beiden Komponenten. Wichtig ist, dass klar ist, dass es immer Spektren sind. Es gibt kein An- und Ausschalter. Hieße: Ein bisschen weniger Eisen = ein bisschen mehr HIF-1α.
HIF-1α also, so scheint es, reguliert im Umkehrschluss die Glukose-Aufnahme via Erhöhung der Insulin-Rezeptor- und Glukosetransporter-Konzentration. Auch das ergibt durchaus Sinn. Erklärt zum Beispiel hier.
Eisen reguliert Insulin-Rezeptor-Funktion und anabole Downstream-Targets
Weitere Untersuchungen ergaben erneut, dass Eisen-Depletion zur deutlichen Erhöhung der Insulin-Rezeptor-Konzentration führt. Doch nicht nur das, auch die Insulin-Bindung an den Rezeptor war deutlich besser. Umgekehrt verschlechterte die Eisen-Gabe die Insulin-Bindung deutlich!
Auch wurde bestätigt, was wir alle erahnen konnten: Der anabole Signalweg war aktiver (PI3K/Akt-Weg), erneut wurde gezeigt, dass die Glukose-Transporter-Konzentration dramatisch höher war und, ganz wichtig, auch die glykolytischen Enzyme wurden entsprechend nach oben reguliert.
Im Tier: Eisen steuert den Glukose-Stoffwechsel
Wie gesagt, die Forscher gaben sich Mühe. Es folgte noch ein In-Vivo-Modell. Das ist der wichtigste Teil.
Zwei Gruppen Ratten. Die eine Gruppe wurde mit unserem Eisen-Chelator behandelt. Die Körpergewichte unterschieden sich nicht deutlich. Die Eisen-Chelator-Gabe halbierte den Leber-Eisen-Gehalt und halbierte den Blut-Eisen-Gehalt (spielt für uns sowieso keine Rolle, da Ferritin der Marker der Wahl ist). Der Hämatokrit-Wert sank zwar, aber nicht sehr deutlich, es bleibt fraglich, ob die Tiere eine Anämie entwickelten.
Der Punkt ist:
- Niedrigere Nüchtern-Blutzucker-Werte
- Nahezu halbierte Insulin-Werte
- Bis zu 10-mal (!!) mehr Glukose-Transporter-RNA (Vorstufe des Proteins)
- Die Insulin-Rezeptor-Dichte lag nun bei 600 % (!!)
- HIF-1α-Konzentration verdoppelte sich
- Der anabole Signalweg (gemessen: Akt und Co.) war deutlich aktiver
(Grafik: A, B, C, D, weiße Balken: ohne Eisen-Chelator, schwarze Balken: mit Eisen-Chelator.)
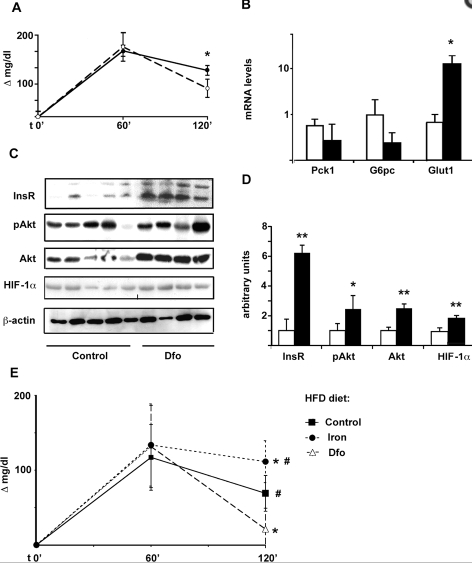
In einem weiteren In-Vivo-Modell, dieses Mal wurden die Tierchen gemästet, war die Glukose-Toleranz der Eisen-Chelator-Gruppe dramatisch verbessert. Durchgeführt wurde ein Glukose-Toleranz-Test: Nach 120 Minuten betrug die Blutglukose-Konzentration der Eisen-Chelator-Gruppe nur einen Bruchteil der Kontrollgruppen-Konzentration und eine Eisen-Supplementation erhöhte sogar diese Werte noch (Grafik: E). Wichtig ist, dass in diesem Modell typischerweise eine Insulin-Resistenz entsteht, freilich einhergehend mit einer Glukose-Intoleranz. Hier also zeigt sich, dass Eisen-Depletion diese Effekte zumindest teilweise puffern kann.
Zusammengefasst
Zusammenfassen kann man die Ergebnisse wie folgt:
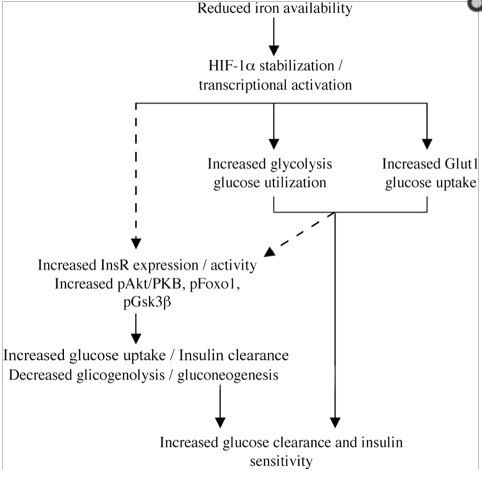
Diese Ergebnisse sind in ihrer Aussage vollkommen konform mit anderen Studien-Resultaten. Die Ergebnisse legen nahe, dass Eisen alleine ganz signifikant den Glukose-Stoffwechsel reguliert und steuert. Dies gilt sowohl für diese Modelle, als auch für In-Vivo-Situationen im Menschen, denn auch hier wurde Ähnliches gezeigt, in ähnlichem Ausmaß – das Gute: Ohne dabei eine Anämie bzw. einen massiven Mangel zu induzieren.
Eisen-Stoffwechsel: Ein Kandidat, um Gesundheit zu „lenken“
Systemisch betrachtet bringt mich das zu unserer heutigen Ernährungslandschaft. Wir, Menschen der Western Society, wundern uns über die Fähigkeit diverser Kulturen, exorbitante Mengen an Kohlenhydraten zu verzehren, ohne dabei die klassischen Symptome zu erfahren, die wir hier angeblich aufgrund des Kohlenhydrat-Konsums erfahren. Nun glaube ich, dass manche Menschen sich daraus eine selbsterfüllende Prophezeiung bauen und ihre Glukose-Toleranz nachhaltig zerschießen, wenn sie zu einer reinen Fleisch-basierten Ernährung switchen. Umgekehrt nämlich, da muss ich direkt an die Blue Zones denken, schaufeln diese Menschen vermutlich nicht nur weniger Häm-Eisen (= beste Bioverfügbarkeit) in sich hinein, sondern nutzen auch die Vorteile der Phytinsäure, die vermutlich als In-Vivo-Chelator fungiert. Auch Grüntee via EGCG wirkt so.
Spinnen wir das Konstrukt weiter und sehen die vielen Verbindungen, wird klar, dass man mit Eisen vorsichtig umgehen sollte. So ist Eisen involviert in vielerlei Pathogenesen, insbesondere auch bei der so gefürchteten Alzheimer-Erkrankung. Tatsächlich lassen sich viele Gesundheitseffekte, die durch Kalorienrestriktion hervorgerufen werden, durch Eisen-Restriktion mimen – zumindest in Modell-Organismen. So auch die Länge der Lebensspanne. Kalorienrestriktion verringert auch die Eisen-Konzentration des Gehirns, die mit zunehmenden Alter steigt.
Ich finde, dieses Beispiel ist großartig, um zu demonstrieren, worum es uns eigentlich geht. Gesetze dahinter erkennen. Den Körper erkunden, wissen, wann, wie und warum etwas ist, wie es ist.
Wer also keine „Kohlenhydrate verträgt“, aber einen Ferritin-Wert von 150-200 hat, der … na ja, weiß nun Bescheid.
Bevor wir dieses Kapitel vorerst abschließen, will ich anmerken, dass man diese Ergebnisse auch zur Kenntnis nehmen und … Low-Carb leben kann. Mit hohen Eisen-Werten. Kein Problem. Aber der basale Anabolismus ist weniger stark ausgeprägt und die Glukose-Toleranz deutlich eingeschränkt. Soll heißen: Nicht lästern über die schlechten Kohlenhydrate, während man selbst alles andere als die optimalen Bedingungen für eine optimale Glukose-Utilisation mitbringt.
Und der vegane Bodybuilder … macht wohl mehr richtig als bisher gedacht :-) Zumindest in puncto Glukose-Toleranz.
Literatur
Belaidi, Abdel A.; Bush, Ashley I. (2015): „Iron neurochemistry in Alzheimer’s disease and Parkinson’s disease: targets for therapeutics“. In: J. Neurochem.., S. n/a-n/a, DOI: 10.1111/jnc.13425.
Cheng, Kim; Ho, Kenneth; Stokes, Rebecca u. a. (2010): „Hypoxia-inducible factor-1α regulates β cell function in mouse and human islets“. In: Journal of Clinical Investigation. 120 (6), S. 2171-2183, DOI: 10.1172/jci35846.
Cook, Christopher I; Yu, Byung Pal (1998): „Iron accumulation in aging: modulation by dietary restriction“. In: Mechanisms of Ageing and Development. 102 (1), S. 1-13, DOI: 10.1016/s0047-6374(98)00005-0.
Dongiovanni, Paola; Valenti, Luca; Ludovica Fracanzani, Anna u. a. (2008): „Iron Depletion by Deferoxamine Up-Regulates Glucose Uptake and Insulin Signaling in Hepatoma Cells and in Rat Liver“. In: The American Journal of Pathology. 172 (3), S. 738-747, DOI: 10.2353/ajpath.2008.070097.
Jellinger, K.; Paulus, W.; Grundke-Iqbal, I. u. a. (1990): „Brain iron and ferritin in Parkinson’s and Alzheimer’s diseases“. In: J Neural Transm Gen Sect. 2 (4), S. 327-340, DOI: 10.1007/bf02252926.
Mandel, S et al. „Green tea catechins as brain-permeable, non toxic iron chelators to “iron out iron” from the brain.“ Oxidative Stress and Neuroprotection (2006): 249-257.
Massie, Harold R.; Aiello, Valerie R.; Williams, Trevor R. (1993): „Inhibition of iron absorption prolongs the life span of Drosophila“. In: Mechanisms of Ageing and Development. 67 (3), S. 227-237, DOI: 10.1016/0047-6374(93)90001-8.
Schiavi, Alfonso; Maglioni, Silvia; Palikaras, Konstantinos u. a. (2015): „Iron-Starvation-Induced Mitophagy Mediates Lifespan Extension upon Mitochondrial Stress in C. elegans“. In: Current Biology. 25 (14), S. 1810-1822, DOI: 10.1016/j.cub.2015.05.059.
Weinreb, Orly et al. „Neuroprotective molecular mechanisms of (−)-epigallocatechin-3-gallate: a reflective outcome of its antioxidant, iron chelating and neuritogenic properties.“ Genes & nutrition 4.4 (2009): 283-296.

20 comments On „Ich vertrage keine Kohlenhydrate“: Hier ist die Lösung
Hallo, ich vertrage überhaupt keine kohlenhydrate. Mein Ferritinwert liegt bei 360 ug/l und mein Eisenwert bei 169 ug/dl. Kann das auf eine Insulin-Sensitivität hindeuten? LG
Hallo,
Mein Ferritinwert liegt nur bei 20 jedoch ist mein Hämoglobin ganz oben am Anschlag und die Ferritinsättigung ist auch hoch, wie kann man das erklären? Mein Arzt rät wegen des mehr als guten Hämoglobin und der Sättigung von der Einnahme von Eisen ab…
huhu, also wenn ich den Artikel richtig verstehe dann ist ein hoher Eisenspiegel schlecht für die Insulinsesitivität. Wie sieht es aus wenn der Eisenspiegel zu niedrig ist?
Ich hab eigentlich immer zu wenig rote Blutkörperchen und mein Eisen ist auch voll oft schlecht, d.h. ich muss um einen „normalen“ Eisengehalt zu haben immer Tablette zu mir nehmen.
Wie wirkt sich das auf die Insulinsnsivität aus?
Meine Freundin nimmt recht grosse Mengen an EGCG und Curcumin. Ich weiss nicht welchen Eisenwert sie hat, aber könnte es bei ihr zu negativen Folgen kommen, wenn durch die Supplementierung der Eisenwert beeinträchtigt wird?
Hallo, könnt ihr bitte noch mal die evtl. Wirkung von Grüntee auf den Eisenwert erklären? Sinkt dieser durch das EGCG und meine Insulinsensitivität nimmt daher zu? (grob ausgedrückt) Vielen Dank. Gruss
Hi Markus,
ja, das scheint so zu sein: EGCG bindet Eisen und fungiert somit als Eisen-Chelator mit entsprechenden Folgen, auch Neuroprotektion (z. B. gegen Alzheimer o. Ä.).
So wirkt u. a. auch Curcumin, was hierbei um ein Vielfaches stärker zu wirken scheint als EGCG.
LG, Chris
Guten Morgen…
Ich hab jetzt Frage dazu.Mein Eisenwert lag im Dez. bei 210.
Macht es für mich dann Sinn eher Low Carb zu sein?Seit ich mehr Carbs esse bin ich schon schwammiger geworden.War aber nie richtig Low Carb unterwegs.
Wiederum ist mein hdl auch niedrig und Chris hatte irgendwo mal geschrieben, dass ein niedriger hdl nicht für low carb geeignet sei.
Verwirrte Grüße
Sascha
Hi Sascha,
dein Eisen-Wert oder dein Ferritin-Wert? Ein so hoher Ferritin-Wert (relativ zu dem, was wir hier geschrieben haben) wird die Glukose-Toleranz deutlich einschränken.
Aufpassen: Ich habe nicht gesagt, dass man kein Low-Carb machen soll, wenn der HDL-Wert niedrig ist. Ich sagte: Eine fettlastige Ernährung ist ungünstig, weil ein niedriger HDL aufzeigt, dass wenig(er) Fett aus dem Blut „geklärt“ wird via Lipoprotein Lipase. Umgekehrt kann der HDL-Wert aber ansteigen, wenn man diesen Zustand verbessert: zum Beispiel durch Low-Carb, bei dem man einige Wochen das eigene Körperfett nutzt. Ein niedrigerer HDL-Wert ergibt sich oft dann, wenn der Fettturnover niedriger ist, auch zum Beispiel bei Carb-lastigen Ernährungsformen. Das ist in diesem Setting aber kein Problem.
Aber: Noch einmal, ich sagte: Wer Fettdiäten praktiziert (keto/high fat) und niedrige HDL-Werte hat, sollte das schlicht über- bzw. bedenken.
LG, Chris
Es war der Ferritin-Wert.
Danke für die schnelle Antwort:-)
Hallo Chris.
Du schreibst gut nachvollziehbar, dass sich hoher Eisenspiegel im Körper
und gute Insulinsesitivität / gute Glucose-Toleranz entgegen stehen.
Wie beeinflusßt das aber z.B. die Körperliche (Ausdauer)Leistungsfähigkeit?
Du beschreibst einen Ferritin-Wert von 150-200 schon als eigentlich schon zu hoch für eine gute Kohlenhydratverträglichkeit.
Dr. Strunz vertirtt demgegenüber die Meinung „bei einem Wert von unter 300 geh ich erst gar nicht an den Start)?
Sind das tatsächlich konträre Standpunkte oder läßt sich das durchaus miteinander „verheiraten“?
Korrelieren Glukoseverträglichkeit auf der einen Seite und Ausdauerleistungsfähigkeit auf der anderen Seite? Oder kann ich eine gute Glukoseverträglichkeit aufweisen und trotzdem bei der Ausdauerfähigkeit leiden, weil aufgrund des niedrigen Eisenspiegels Sauerstoffversorgung und enzymatische Aktivität reduziert sind?
LG,
Thorsten
Hi Thorsten,
deine Fragen sind sehr gut und tatsächlich auch Aspekte, über die ich bereits länger nachdenke.
Zunächst einmal gilt freilich, dass der Artikel sich auf Tiere und Menschen bezieht, die nicht täglich joggen oder andere intensive Ausdauerleistungen erbringen.
Ausdauersport an sich hilft nämlich natürlich, die Glukose-Toleranz auch bei vermeintlich schlechten Bedingungen zu wahren.
Aber auch hier gilt: Ausdauersport verlagert den (muskulären) Stoffwechsel in Richtung Fettsäure-Oxidation und wird entsprechend auch Fettsäuren als Primärsubstrat bevorzugen, sodass der Gesamt-Glukose-Verbrauch natürlich geringer ausfällt, was sich m. E. auch auf die Glukose-Verträglichkeit auswirkt – so jedenfalls habe ich das erfahren.
Wenn wir Studien am Menschen anschauen, kann sogar der Abfall des Ferritins von 70 auf 40 noch dramatische Verbesserungen der Insulin-Sensitivität mit sich bringen. Soll heißen: 150-200 war eine sehr konservativ gewählte Zahl und 300 wäre massiv over the top. Dazu empfehle ich auch die Lektüre von ED Weinberg (Hidden Dangers of Iron), wobei 300 schon Eisenüberladung wäre.
Grundsätzlich ist der Ferritin-Ausdauersport-Fokus m. E. nicht adäquat genug, um so hohe Ferritin-Werte zu legitimieren, gerade auch in Anbetracht der Tatsache, dass Eisen signifikant negativ viele gesundheitliche Aspekte regulieren kann. Dazu werden wir in den nächsten Wochen noch einmal schreiben.
Ich denke, fokussiert man tatsächlich nur die Ausdauerleistung (und ignoriert kurz alles andere), kann der Eisen-Wert durchaus helfen, mehr Leistung zu vollbringen. Die Frage ist: Gilt das für den Normalo oder nur für Hochleistungssportler, die die letzten 1, 2, 3 % verbessern wollen. Soll heißen: Lohnt es sich sich quasi mit Eisen zu überladen, dafür aber 10 Minuten besser zu sein bei … einem Marathon o. Ä. – Wo liegt der Cut-Off? Das heißt: Wie viel Eisen bringt mir die maximale Wirkung? Brauche ich wirklich 300? Oder ist die Grenze schon bei 100-150?
Grundsätzlich aber gilt: Eine gute Glukose-Toleranz hängt eng zusammen mit dem anaeroben Stoffwechsel (wie gezeigt) und passt hier eher zu Kraftsportler (auch das ergibt Sinn), als zu einem Ausdauerathleten, der unbedingt den oxidativen Stoffwechsel verbessern und ausbauen will.
Lange Rede: Ich kann dir deine Fragen nicht eindeutig beantworten. Leider.
(Edit: Ferritin ist auch nur ein Eisen-Speicher und wenn der steigt, sollten alle Eisen-Systeme eigentlich schon längst gesättigt sein, auch Myoglobin, Enzyme der Atmungskette und allen voran auch Hämoglobin. Inwieweit da eine strenge Korrelation zwischen Ferritin, Myoglobin und Co. vorhanden ist, kann wohl keiner sagen, da es keine Studien dazu gibt. Es wird mit Sicherheit eine Korrelation geben, doch bis zu welchem Wert? Denn im Körper ist nichts unendlich linear.)
sehr spannendes Thema:-) Ab welchem Ferritin-Wert werden die Zellen denn nicht mehr ausreichend mit Eisen versorgt oder ab wann und warum nicht die Leistung ab? Ferritin sind ja die Speicher und so lange ich doch überhaupt einen Speicher bzw. Ferritin Wert habe, müsste doch auch genug Eisen im System sein oder nicht?
Also generell sollten alle Systeme abgesättigt sein, sobald der Ferritin-Wert deutlich steigt, z. B. von 50 auf 100 o. Ä.
Ferritin ist, richtig, der Speicher. Ferritin ist – gemessen anhand der Eisenlagerung – deutlich konzentrierter als Myoglobin und alle Sub-Systeme (z. B. Cytochrome) zusammen, ungefähr um den Faktor 3. Hämoglobin seinerseits ca. 2,5-fach konzentrierter als Ferritin. Soll heißen: Das meiste Eisen im Körper liegt im Hämoglobin.
Bei negativer Eisen-Balance fallen die Ferritin-Werte zunächst rasch, dann aber langsamer (wohl, weil der Körper effizienter damit umgeht).
Erst bei ca. 15 ng/ml (Ferritin) beginnt das Kollabieren: Hämoglobin fällt deutlich, sowie auch die Tansferrin-Sättigung. Zeitgleich ist auch der Zellgehalt zu niedrig, um die optimale Aktivität div. Enzyme zu gewährleisten. Spätestens ab dann fühlt man sich wohl schrecklich.
Umgekehrt weiß man von Eisenüberladung, dass die höhere Hämoglobin-Werte vorweisen, was dafür spricht, dass der Hämoglobin-Wert durchaus auch noch bei exorbitanten Eisen-Mengen ansteigen kann, quasi als Zusatzboost. Ob das sinnvoll ist oder nicht, weiß keiner.
Heißt: Es ist schwer zu sagen, wie sich das System bei Ferritin-Wert-XY verhält.
Fakt ist aber, dass beide Extreme wohl wenig förderlich sind, wenn man das Gesamtbild betrachtet und wir durchaus einen gewissen Spielraum haben.
Ich habe einen Ferritinwert von <15 ng/ml. Man kann jetzt nicht wirklich sagen, das ich zu den Sprintern gehöre, aber lange Ausdauereinheiten sind durchaus drin.
Super spannendens weil teils wirklich sehr gegensätzliches Thema.
Unter 15 ist nach der gängigen Lehrmeinung definitiv zu tief. Wie sind denn Hb und sTf? Hast Du Symptome (Kurzatmigkeit, Herzklopfen, Atemnot, Hautrisse, Blässe, Müdigkeit, etc.) ? Viele Experten würden hier definitive Eisen-Saccharose i.v. infundieren.
Echt gut aufbereitetes Thema – ich wusste das mit der inversen Insulinsensitivität bis dato gar nicht so en detail!
Etwas konträr gegen die Fraktion der Eisenverfechter (u.a. Dr. Schaub in der Schweiz und Konsorten, welche in den letzten Jahren sehr offensive ihre „Eisenzentren“ zur i.v. Eisenbehandlung ausgebaut haben).
Die Frage ist schon, ob und was einem ein höherer Ferritinwert bei ausreichender homöostatischer Eisenaufnahme (regelm. rotes Fleisch ohne gleichzeitig Phytate etc.) und Fehlen von Eisenmangelsymptomen bringt.
Wenn die Speichersysteme (allen voran Hb, aber auch Myoglobin und die Eisen-dependenten Ezyme der Atmungskette) bereits im unteren Normbereich des Ferritins ja abgesättigt sind, wäre ja alles ok und höhere Ferritinwerte würden bei fehlendem Benefit mehr schaden als nutzen.
Dennoch profitieren offenbar laut der der Erfahrungsberichte viele Patienten von den Eiseninfusionen und einem Anheben des Ferritins auf einen Wert über 50-100 ng/ml.
Der Normwert solle gemäss einiger der Experten bei 50 ng/ml beginnen statt bei bisherigen 30-35 wie derzeit (bei Männern).
Die Frage die ich mir stelle, wo der Break-Even-Point ist zwischen optimaler Eisenversorgung (dann dürften zumindest keine Eisen-bedingten Mangelsymptome auftreten) sowie einer guten Glukosetoleranz.
Sprich: kann ich zB die roten Muskelfasern entsprechend maximal Absättigen mit einem ausreichenden Myoglobin und Atmungsketten-Eisengehalt und dennoch eine gute Glukosetoleranz der Ft-Fasern behalten?
Hallo 4D Doc, hallo Chris,
wirklich spannendes Thema, ich sehe auch die positiven Effekte bei einer Erhöhung des Ferritin auf über 50 entsprechend Dr. Schaub etc, auf der anderen Seite hatte ich eine Pat./Sportlerin, die hat mit einem Ferritin von 9 einen Ironman in guter Zeit gefinished, laut Lehrbuch eher nicht erklärbar, da muss es tatsächlich noch mehr Aspekte geben …
Gruss Niels
Krass! Zumal jener bei dieser Ausdauer-Disziplin ja explizit geforderte Fettstoffwechsel der langsamen, oxidativen Fasern eigentlich ja deutlich! beeinträchtigt sein müsste.
Andererseits, wenn alle Enzyme noch ausreichend abgedeckt waren – zeigt einmal mehr die Individualität. Eigentlich super: alle Eisensysteme anscheinend, wenn auch grenzwertig, abgedeckt, also keine Symptome (im Gegenteil : Ironman absolviert!), und zugleich den Vorteil der geringen Eisenlast in Hinblick auf die negativen pro-oxidativen und neurotoxischen Effekte.
Zumindest bei Entzündungen verschiebt sich das Gleichgewicht Eisenspeicher zu den freien Eisensystemen wie Hämoglobin in Richtung Ferritin.
So bei mir: grenzwertig niedriger Hämoglobinwert, aber Ferritin über 200!
Stellt sich für mich die Frage, ob bei so einseitiger Eisenüberladung trotzdem die Insulinsensitivität leidet? Soll heißen, ist der Ferritinwert der alleinige Parameter dafür?
Die Frage ist, ob es überhaupt einen strengen Kausalzusammenhang zwischen Ferritin und Hämoglobin gibt.
Denn: Hämoglobin wird nun mal durch viele andere Faktoren außerhalb der Eisen-Verfügbarkeit reguliert.
Soll heißen: Da muss nicht zwangsläufig eine Entzündung dran schuld sein. Bei Entzündungen im Allgemeinen reagiert die IS stark negativ.
Strunz praktiziert eine Very Low Carb Diät, so dass er sich auch extrem hohe Ferritin-Werte „leisten“ kann.