Die Leptinresistenz. Häufig wird über sie geschrieben und in etwa weiß man etwas damit anzufangen. Dennoch ist sie recht schwammig definiert und selbst in Forschung und Klinik würde man sich eine Konkretisierung des Begriffs wünschen (Myers et al., 2012). Ohne weiter auf dieses Definitionsproblem einzugehen möchte ich in diesem Artikel einige Konzepte zur Entstehung einer Leptinresistenz diskutieren und im Zuge dessen einen oftmals übersehenen Zelltyp im Gehirn vorstellen – die Gliazellen.
Zu guter Letzt möchte ich eure Aufmerksamkeit auf eine brandaktuelle Studie lenken, welche von einem vielversprechenden Pflanzenextrakt mit Leptin-sensitivierender Wirkung handelt.
Leptin – Ursprünge und Grundwissen
Die Geschichte beginnt 1950. Eine spontane Mutation ist in einer Labormaus der Versuchstierzucht von Jackson Laboratory aufgetreten (Ingalls et al., 1950). Beim Betrachten dieser Maus wurde jedem sofort ersichtlich, dass etwas mit ihr nicht stimmen konnte. Diese Maus war nämlich überaus adipös und hatte einen nicht zu stillenden Hunger. Glücklicherweise stellte man die richtigen Fragen und ging der Sache auf den Grund. Besser gesagt, man versuchte die Erscheinung der Maus (=Phänotyp) durch Veränderungen in der Erbinformation (=Genotyp) zu erklären. Heute wissen wir, dass dieser Fettleibigkeit ein ganz bestimmtes mutiertes Gen zu Grunde lag:
Das ob-Gen
Es stellt den Bauplan für das Hormon namens Leptin dar (Zhang et al., 1994).
Leptin ist mittlerweile enorm populär. Seine Entdeckung vor 20 Jahren bildet gewissermaßen die Basis der Adipositas-Forschung und prägte maßgeblich unser Verständnis der Energie-Homöostase (Friedman & Mantzoros, 2015).
Leptin kennt man im Volksmund als “Sättigungshormon” und inzwischen wird es auch immer häufiger auf (Sport-)Ernähurngsblog’s erwähnt. Bevor ich etwas tiefer in die Materie einsteige, sollte ich wohl dennoch die Grundlagen ansprechen.
Leptin ist ein zirkulierendes Hormon, welches haupsächlich vom weißen Fettgewebe produziert wird. Bemerkenswerterweise korrelieren die Leptinspiegel mit der Menge des Depotfetts (Considine et al., 1996). Leptin ist also eine Art Feedback-Signal. Seine Blutkonzentration spiegelt den “Füllstand” der weißen Fettzellen wieder und ist somit ein Indikator für die langfristige Verfügbarkeit von Energie.
Besonders das Gehirn registriert Fluktuationen der Leptinspiegel und passt über Nervenzell-Netzwerke das Essverhalten und den Energieverbrauch an die jeweilige Situation an (Campfield et al., 1996; Saper et al., 2002). Somit kann der Körperfett in einem physiologischen Bereich gehalten werden.
Bedeutet:
wenig Depotfett = wenig Leptin = mehr Hunger + langsamer Stoffwechsel
viel Depotfett = viel Leptin = weniger Hunger + schneller Stoffwechsel
Leptin, der Hirnstamm und die Mahlzeitengröße
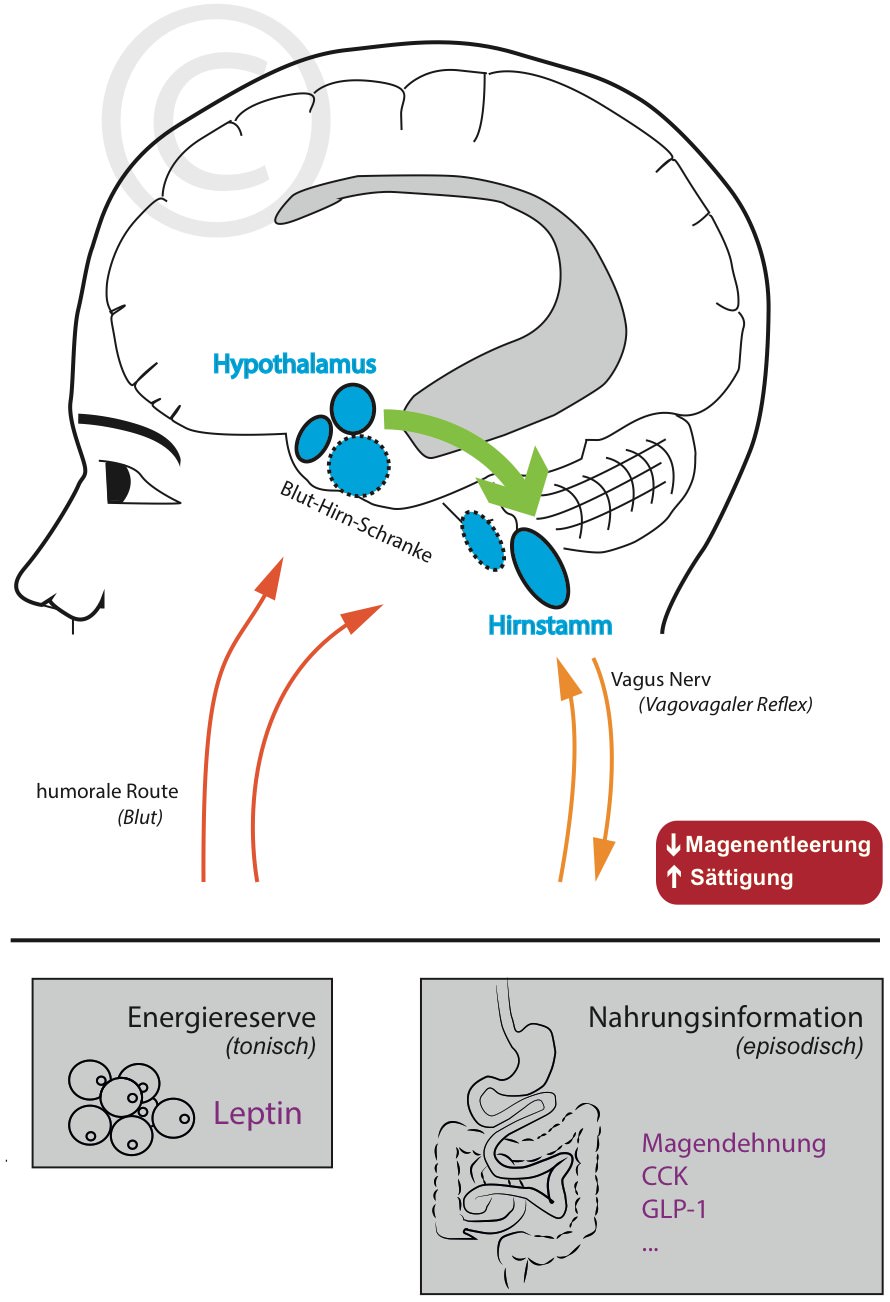
Im Hypothalamus werden Nervenzellen durch Leptin aktiviert, die über absteigende Nervenfasern mit dem Hirnstamm kommunizieren (Blevins, 2004). Dort wird unter anderem die Magenentleerungsrate und damit die Mahlzeitengröße reguliert. Dies geschieht über den sogenannten Vagovagalen Reflex.
Eine Aufgabe des Vagus Nerv ist es, dem Hirnstamm mitzuteilen (a) wie sehr der Magen gedehnt wird und (b) ob anorexigene Darmhormone ausgeschüttet wurden wie zum Beispiel CCK oder GLP-1.
Mit zunehemender Nahrungsaufnahme wird reflexartig die Rate der Magenentleerung reduziert wodurch das Völlegefühl (“Sättigung”) entsteht (Malagelada et al., 1976; Kaplan et al., 1997; van der Velde et al., 1999).
Leptin scheint diesen Reflex über hypothalamische Nervenfasern positiv modulieren zu können damit die Sättigung früher erzielt wird (Langhans & Geary, 2006; Berthoud, 2008; Camilleri, 2015).
Besitzt man nun genug Fettreserven (=viel Leptin) reagiert man also sensibler auf Signale des Magen-Darmtrakts. Fastet man oder weist einen niedrigen Körperfettanteil auf (=wenig Leptin) werden die Mahlzeiten in der Regel größer.
Info
Neben der homöostatischen Regulation spielt – insbesondere beim Menschen – auch die Schmackhaftigkeit und der hedonische Wert eines Lebensmittels eine große Rolle (Saper et al., 2002).Leptin beeinflusst zum Beispiel zusätzlich die dopaminergen “Belohnungszentren” und damit höhere Gehirnfunktionen (Hommel et al., 2006; Lenninger et al., 2009)
Weshalb Leptin den großen Erwartungen (bisher) nicht standhielt
Die ursprüngliche Überlegung, dass Übergewichtige schlicht Probleme mit der Produktion dieses “Sättigungssignals” hätten, wurde recht bald für den Großteil der Fälle zerschlagen; und somit der Traum der einfachen Adipositas-Therapie durch eine simple Leptin-Substitution.
In Adipösen zirkulieren, auf Grund der hohen Fettmasse, nämlich enorme Konzentrationen an Leptin (Considine et al., 1996). Dennoch beobachtet man bei ihnen eine ungehemmte Nahrungsaufnahme (Hyperphagie).
Adipositas
BMI >30
besser Taillenumfang >88cm (Frau) bzw. >102cm (Mann)
‚waist-to-hip-ratio‘ >0,85 (Frau) bzw. > 0,9 (Mann)
Das beruht auf einer Leptinresistenz. Der Adipöse reagiert also nicht adäquat auf das viele Leptin. In adipösen Versuchtstieren wurde jedoch wiederholt gezeigt, dass eine Leptingabe direkt in den Hirnventrikel – im Gegensatz zu peripheren Injektionen – den erwarteten Effekt einer stark reduzierten Nahrungsaufnahme bewirkt.
Daher rührt der ursprüngliche und recht simple Gedanke eines beeinträchtigten Transports von Leptin über die Blut-Hirnschranke.
Wie aktuelle Arbeiten äußerst elegant zeigen konnten, scheint dies tatsächlich so zuzutreffen (Balland et al., 2014). Den Transport von Leptin in das Gehirn pharmakologisch zu ermöglichen wird wohl eine von vielen zukünftigen Behandlungsstrategien der Adipositas darstellen.
Glia-Zellen: Türhüter an der Blut-Hirnschranke?
Ähnlich wie der Mann vom Lande in Kafka’s “Vor dem Gesetz” gelangen zirkulierende Faktoren nicht ohne weiteres in das Gehirn. Zum einen gibt es da die Blut-Hirnschranke, die nur an bestimmten Bereichen sowie nur für bestimmte Substanzen durchlässig ist (=neurohämale Schnittstelle). Und selbst wenn die Substanzen aus der Blutzirkulation ins Gehirn übergetreten sind liegen möglicherweise noch einige Zellen zwischen ihnen und der Zielzelle.
Eine dieser Zellbarrieren bilden die sogenannten Glia-Zellen, der zweite Zelltypus im Gehirn neben den Nervenzellen. Im Griechischen steht glia für “Leim” und zur Zeit seiner Entdeckung betrachtete man die Glia tatsächlich als simples Stützgewebe. Heute ist bekannt, dass Glia-Zellen die Nervenzellen in ihrer kommunikativen Funktion unterstützen.
Info
Ich verkneife mir hier bewusst die an dieser Stelle typischen Ausführungen zur zahlenmäßige Überlegenheit der Glia-Zellen im Gehirn. Viele Forscher verweisen in ihren Einleitungen nämlich häufig auf ein Glia-zu-Neuronen Verhältnis von 10:1 oder höher – vermutlich um die Bedeutung ihres Forschungsfelds zu unterstreichen. Allerdings wird inzwischen immer häufiger vermerkt, dass dies ein nicht ausreichend belegter und oftmals naiv rezitierter Mythos sein könnte. Auch wenn die Ratio sehr stark vom Gehirnbereich und der betrachteten Spezies abhängt, besteht Evidenz, dass sie letztendlich doch näher bei 1:1 liegen könnte – auch im Menschen (Azevedo et al., 2009).Die Bedeutung der Glia ist inzwischen so oder so hinreichend belegt so dass man sich theoretisch nicht mehr mit der putativen und wenig-validen Überzahl an Zellen rechfertigen müsste. Zukünftige Forschung wird hier hoffentlich Klarheit verschaffen.
Bezüglich ihrer Funktion gilt es allerdings als gesichert, dass Glia-Zellen die Ausbildung von synaptische Verbindungen strukturell unterstützen können. Zusätzlich greifen Glia-Zellen direkt über das Ausschütten sogenannter Gliotransmitter in die Neurotransmission ein (Tripartite Synapse). Glia-Zellen vermitteln zwischen Nervenzellen und Blutgefäßen. Somit passen sie den lokale Blutfluss an die Hirnaktivität an und stellen die Versorgung mit Sauerstoff und Energieträgern sicher.
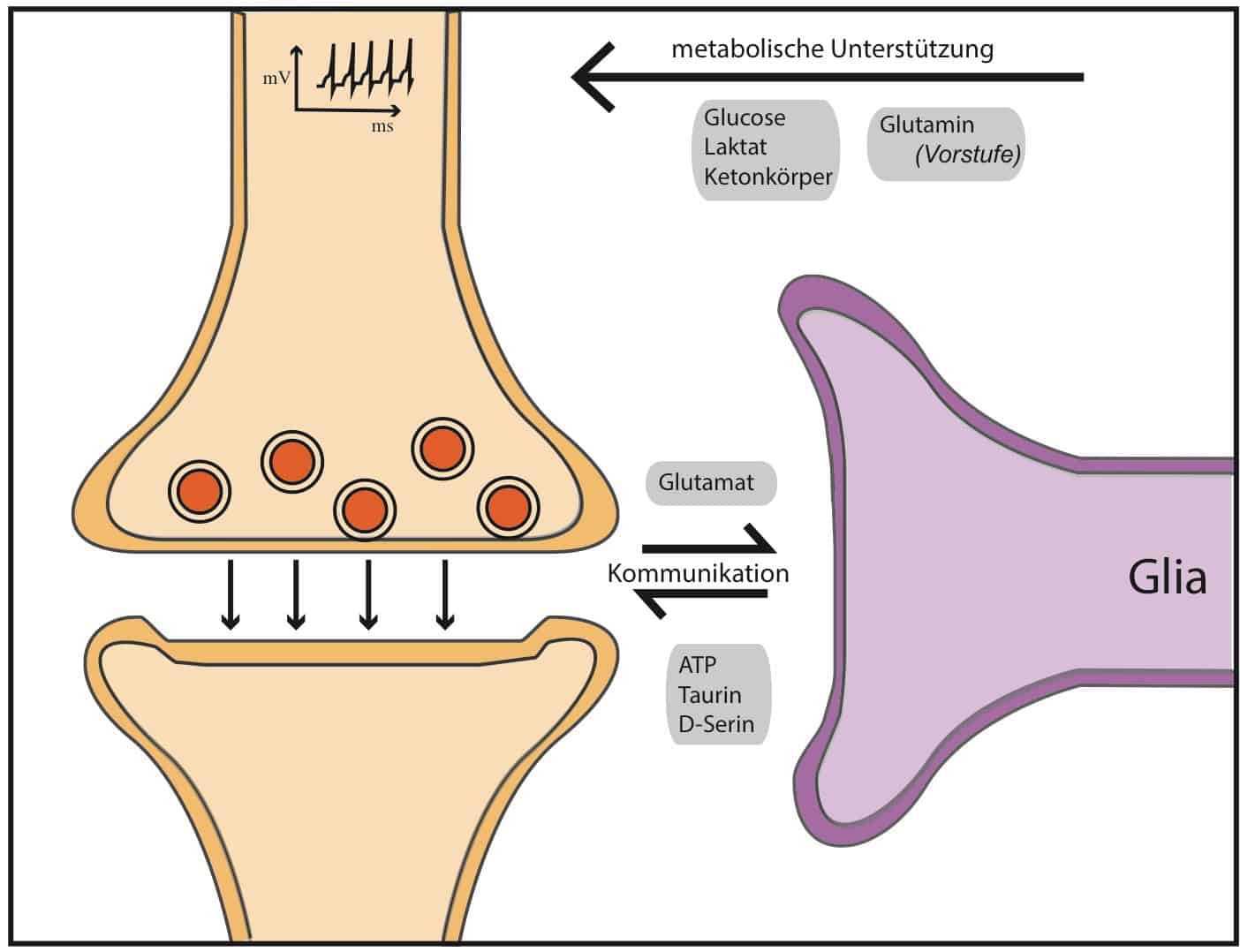
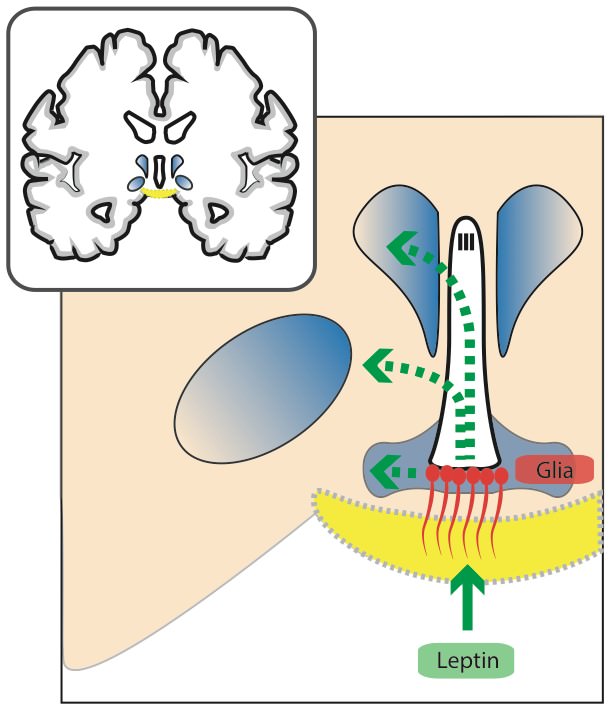
Allerdings scheint zusätzlich der Transport von zirkulierenden Signalstoffen in das Gehirn durch die Glia reguliert zu werden. In einer interessanten Studie wurde gezeigt, dass gewisse Glia-Zellen (Astrocyten & Tanycyten) selbst Leptin-Rezeptoren exprimieren und zirkulierendes Leptin binden (Balland et al., 2014; Kim et al., 2014). In der Folge wird der gebundene Leptin-/Leptin-Rezeptorkomplex inkorporiert, im Hypothalamus verteilt und an die entsprechenden Nervenzellen weitergeleitet.
Info
Dies scheint abhängig von einem gewissen Signalweg zu sein – dem ERK-Signalweg (extracellular-signal regulated Kinase). Da diese Gliazellen bekanntermaßen sehr empfänglich für die Stimulation dieses Signalwegs sind, wurde im Zuge dieser Studie zusätzlich versucht diesen pharmakologisch zu aktivieren und den Leptin-Transport zu steigern (Balland et al., 2014).Die periphere Gabe eines bestimmten Wachstumsfaktors (EGF) schien hier recht gut zu funktionieren. Allerdings ist Vorsicht geboten mit Hinblick auf das therapeutische Potential, da eventuell auch die Durchlässigkeit der Blut-Hirnschranke für andere Substanzen erhöht wird (Gao et al., 2014).
Aus dem ‚Leim‘ gehen:
Schlechte Ernährung schadet Glia und Leptin-Sensitivität
Im Kontext der Adipositas sind systemische Entzündungen ein wichtiger Faktor. Man hat vielleicht schon davon gelesen, dass das (viszerale) Fettgewebe in Adipösen häufig von Immunzellen infiltriert wird, sich stark entzündet und strukturell verändert.
Im Hypothalamus kann man ähnliche strukturelle Veränderungen beobachten (Thaler & Schwartz, 2010). Interessanterweise können diese in Nagern schon nach wenigen Tagen auftreten (Thaler et al., 2012). Alles was man dafür tun muss, ist ihnen hoch-kalorisches und pro-inflammatorisches Futter zu geben (äquivalent zur typisch-westlichen “Cafeteria Diet”).
Info
Im Fettgewebe treten Entzündungen später und eher als Folge der Fettzunahme auf.
Die hypothalamische Entzündung hingegen entsteht rapide – noch bevor Veränderungen der Fettmasse sichtbar werden!Somit könnten diese Veränderungen eventuell sogar ein potentieller Auslöser der Leptinresistenz und Adipositas darstellen.
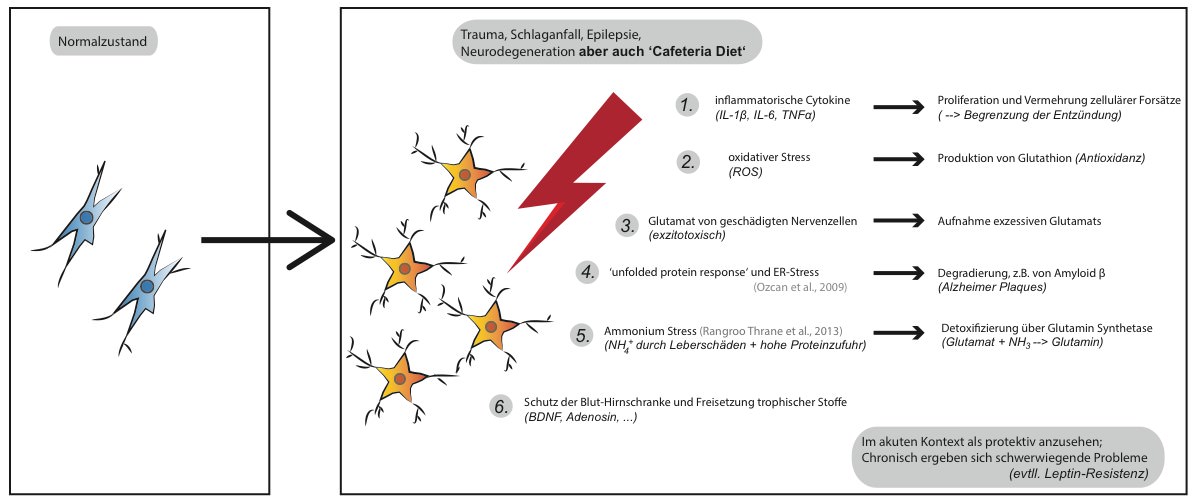
Prinzipiell kann man diese strukturellen Veränderungen im Hypothalamus als tatsächliche Gehirnverletzung bezeichnen, ähnlich solcher in Folge eines Schädel-Hirntraumas oder eines Schlaganfalls.
Mechanistisch spielen unter anderem Entzündungen, oxidativer Stress, Ammonium- und Exzitotoxizität sowie fehlgefaltete Proteine eine Rolle. Die Gehirnzellen im Hypothalamus reagieren hierauf. Wieder einmal ist besonders die Glia involviert und bildet sogenannte Glia-Narben.
Dies sind unter dem Mikroskop klar erkennbare morphologische Veränderung, die typischerweise bei Hirnschädigung zu beobachten sind (reaktive Gliose). Sie zielen unter anderem darauf ab den Schaden zu begrenzen, allerdings sind die Glia-Zellen somit zusätzlich in ihrer Funktion eingeschränkt (Pekny et al., 2014).
Wie wir inzwischen wissen, scheinen die Glia-Zellen äußerst bedeutend für den Leptin-Transport zu sein. Eine pro-inflammatorische ‚Cafeteria Diet‘ könnte folglich den Hypothalamus “vernarben” und dadurch zur Entwicklung einer Leptinresistenz begünstigen.
Im Menschen lassen Aufnahmen mit einem Kernspinntomographen vermuten, dass Adipöse ähnliche strukturelle Schäden im Hypothalamus aufweisen (Thaler et al., 2012). Diese Schäden scheinen zumindest laut Nagerstudien aber reversibel (Berkseth et al., 2014).
Beflügelt durch pflanzliche Leptin-Sensitizer
Durch einen aufmerksamen edubily-Leser bin ich auf die Fährte einer äußerst vielversprechenden Substanz gestossen. Dieser Leser lies mir also einen Link zukommen – Danke nochmals an der Stelle – und ich muss gestehen, ich war äußerst erstaunt.
Studien zu Pflanzenextrakte werden recht inflationär veröffentlicht, die tatsächliche Relevanz ist aber häufig überschaubar.
Als ich jedoch die Referenzen dieser Mitteilung betrachtete, stellte ich fest, dass sie auf einer Publikation im renommierten Journal “Cell” von letzter Woche basierte (Liu et al., 2015).
Es geht um ein ganz bestimmtes Kraut, die sogenannte Wilfords Dreiflügelfrucht (Tripterygium wilfordii). Offenbar wird diese in der traditionellen chinesischen Medizin schon lange zum Beispiel gegen Rheuma oder Arthritis eingesetzt.
Eine in ihr enthaltene Substanz, das Triterpen Celastrol, kann aber angeblich noch viel mehr und scheint laut dieser Studie ein ausgesprochen effektiver Leptin-Sensitizer zu sein.
Die Originalstudie ist durchaus spannend zu lesen und es wurden hochwertige Techniken angewandt um Celastrol überhaupt als bioaktiven Kandidaten zu identifizieren.
Das explizite Ziel war einen Stoff zu finden, der die Fehlfaltung von Proteinen besonders im Gehirn (Hypothalamus) zu reduzieren vermag um somit die Leptin-Sensitivität zu verbessern.
In verschiedenen, adipösen Mausmodellen (genetisch oder Ernährungs-induziert) wurde dann eindrucksvoll bewiesen, dass durch Celastrol-Gabe ein extrem ausgeprägter Verlust an Fettmasse hervorgerufen werden kann. Dieser Verlust ist tatsächlich sehr beeindruckend, verlieren die adipösen Mäuse doch tatsächlich fast die Hälfte ihres Körpergewichts (von 50g auf 25-30g = Normalgewicht).
Und das geschah innerhalb von nur 22 Tagen nach oraler Verabreichung!
Die Nahrungsaufnahme war stark reduziert, was die Autoren nach verschiedenen Versuchen auf eine verstärkte Wirkung von Leptin zurückführen. Interessanterweise genügte übrigens eine Woche von Celastrol um die Blutzuckerkontrolle in adipösen Mäusen stark zu verbessern. Auch schlanke Mäuse profitierten von Celastrol in dieser Hinsicht.
Für schlanke Mäuse scheint Celastrol laut der Studie übrigens als ungefährlich zu gelten, denn Nahrungsaufnahme und Magermasse blieben normal. Es scheint seine sättigende Wirkung also vor allem in adipösen Individuen zu zeigen, welche hohe Leptinspiegel aufweisen.
Auf Grund der Tatsache, das die Nahrungsaufnahme in schlanken Mäusen unverändert bleibt, kann man zusätzlich Folgendes ableiten:
Die orale Celastrolgabe scheint keine gastrointestinalen Probleme und/oder Geschmacksaversion gegenüber nachfolgender Nahrung auszulösen. Eine reduzierte Nahrungsaufnahme auf Grund von Übelkeit wäre natürlich in der klinischen Anwendung alles andere als wünschenswert.
Info
Kalorimetrische Untersuchungen weisen übrigens klar darauf hin, dass Celastrol kein ‚Fat-Burner‘ zu sein scheint. Die behandelten Mäuse bewegten sich sogar eher weniger und hatten einen leicht reduzierten Energieverbrauch über den Tag gesehen.Celastrol scheint einfach ein äußerst potenter Appetitzügler zu sein!
Der genaue Mechanismus wurde leider nicht im Detail eruiert.
Immerhin wurde gezeigt, dass Celastrol im Hypothalamus Gene aktiviert, die den Stress durch fehlgefaltete Proteine reduzieren (=und damit die Leptin-Sensitivität erhöhen?) (Ozcan et al., 2009; Liu et al., 2015).Gleichzeitig wurde eine gewisse Synergie zwischen Celastrol und Leptin nachgewiesen; Celastrol scheint desweiteren seine Wirkung nur in Gegenwart von Leptin entfalten zu können. Dennoch sind dies alles eher vage Hinweise und eine eindeutige Kausalität wurde bisher nicht prsäentiert.
Natürlich wird auch pharmakologisch versucht die Leptin-Sensitivität zu verbessern.
Zu nennen wäre hier zum Beispiel Pramlintide, ein Derivat des pankreatischen Hormons Amylin (Turek et al., 2010). Man sollte sich aber hierbei immer im Klaren sein, dass eine gewisse Therapien häufig nur für eine gewisse Subpopulation in Frage kommt.
Eine Vielzahl an individuellen Faktoren, die variabel miteinander interagieren, scheint gerade hinsichtlich der Leptin-Sensitivität eine Pauschalisierung unmöglich zu machen.
Alles in allem wäre es meiner Meinung nach großartig, würde der Inhaltsstoff einer altbekannten Heilpflanze in neuem Kontext tatsächlich diese Versprechungen halten können.
Die Zukunft wird vielleicht zeigen können, ob Adipösen mit Hyperleptinämie und Leptinresistenz tatsächlich von Celastrol profitieren.
Ausblick
Um diesen Artikel übersichtlich zu halten, werde ich vorraussichtlich einen zweiten Teil über Leptin schreiben.
Angedachte Themen wären:
- Einfluss versch. Ernährungsfaktoren auf die Leptinresistenz (sind es Kohlenhydrate? Oder doch Fett? Paradoxon der Kitava-Ernährung)
- Signalweg des Leptins und die Rolle von SOCS3
- Leptin’s peripheren Effekte, z.B. in der Muskulatur
- der Magen als weitere Quelle für ‚gastrisches Leptin‘ und die Implikationen hiervon
- Geschlechtsunterschiede zwischen Mann und Frau
- Frühkindliche Prägung der Leptin-Sensitivität; Verantwortung der Eltern
- Menschen hinter der Wissenschaft; Profil von z.B. Jeffrey Friedman
Beim Betrachten der Liste könnte es wohl vielleicht doch sogar ein Dreiteiler werden.
Weitere Ideen und Vorschläge sind natürlich immer willkommen. Gerne als Kommentar unter dem Artikel.
Referenzen
Azevedo, Frederico A.C. et al. ‚Equal Numbers Of Neuronal And Nonneuronal Cells Make The Human Brain An Isometrically Scaled-Up Primate Brain‘. J. Comp. Neurol. 513.5 (2009): 532-541. Web.
Balland, Eglantine et al. ‚Hypothalamic Tanycytes Are An ERK-Gated Conduit For Leptin Into The Brain‘. Cell Metabolism 19.2 (2014): 293-301. Web.
Banks, W. A. et al. ‚Triglycerides Induce Leptin Resistance At The Blood-Brain Barrier‘. Diabetes 53.5 (2004): 1253-1260. Web.
Berkseth, Kathryn E. et al. ‚Hypothalamic Gliosis Associated With High-Fat Diet Feeding Is Reversible In Mice: A Combined Immunohistochemical And Magnetic Resonance Imaging Study‘. Endocrinology 155.8 (2014): 2858-2867. Web.
Berthoud, H.-r. ‚Vagal And Hormonal Gut-Brain Communication: From Satiation To Satisfaction‘. Neurogastroenterology & Motility 20 (2008): 64-72. Web.
Berthoud, Hans-Rudolf. ‚Multiple Neural Systems Controlling Food Intake And Body Weight‘. Neuroscience & Biobehavioral Reviews 26.4 (2002): 393-428. Web.
Blevins, J. E. ‚Evidence That Paraventricular Nucleus Oxytocin Neurons Link Hypothalamic Leptin Action To Caudal Brain Stem Nuclei Controlling Meal Size‘. AJP: Regulatory, Integrative and Comparative Physiology 287.1 (2004): R87-R96. Web.
Camilleri, Michael. ‚Peripheral Mechanisms In Appetite Regulation‘. Gastroenterology 148.6 (2015): 1219-1233. Web.
Campfield, L., F. Smith, and P. Burn. ‚The OB Protein (Leptin) Pathway – A Link Between Adipose Tissue Mass And Central Neural Networks‘. Hormone and Metabolic Research 28.12 (1996): 619-632. Web.
Considine, Robert V. et al. ‚Serum Immunoreactive-Leptin Concentrations In Normal-Weight And Obese Humans‘. New England Journal of Medicine 334.5 (1996): 292-295. Web.
Friedman, Jeffrey M., and Christos S. Mantzoros. ’20 Years Of Leptin: From The Discovery Of The Leptin Gene To Leptin In Our Therapeutic Armamentarium‘. Metabolism 64.1 (2015): 1-4. Web.
Gao, Yuanqing, Matthias H. Tschöp, and Serge Luquet. ‚Hypothalamic Tanycytes: Gatekeepers To Metabolic Control‘. Cell Metabolism 19.2 (2014): 173-175. Web.
Hommel, Jonathan D. et al. ‚Leptin Receptor Signaling In Midbrain Dopamine Neurons Regulates Feeding‘. Neuron 51.6 (2006): 801-810. Web.
Ingalls, Ann M., Margaret M. Dickie, and G. D. Snell. ‚Obese, A New Mutation In The House Mouse‘. Journal of Heredity 41.12 (1950): 317-318. Web.
Kaplan, J.M. et al. ‚Gastric Branch Vagotomy And Gastric Emptying During And After Intragastric Infusion Of Glucose‘. American Journal of Physiology 273.5 (1997): 1786-92. Web.
Kim, Jae Geun et al. ‚Leptin Signaling In Astrocytes Regulates Hypothalamic Neuronal Circuits And Feeding‘. Nature Neuroscience 17.7 (2014): 908-910. Web.
Langhans, Wolfgang, and Nori Geary. Frontiers In Eating And Weight Regulation. Basel: Karger, 2010. Print.
Langhans, Wolfgang, and Nory Geary. ‚Obesity And Binge Eating Disorder‘. Acta Paediatrica 95.3 (2006): 382-383. Web.
Leinninger, Gina M. et al. ‚Leptin Acts Via Leptin Receptor-Expressing Lateral Hypothalamic Neurons To Modulate The Mesolimbic Dopamine System And Suppress Feeding‘. Cell Metabolism 10.2 (2009): 89-98. Web.
Liu, Junli et al. ‚Treatment Of Obesity With Celastrol‘. Cell 161.5 (2015): 999-1011. Web.
Malagelada, J.R. et al. ‚Measurement Of Gastric Functions During Digestion Of Ordinary Solid Meals In Man‘. Gastroenterology 70.2 (1976): 203-210. Web. 26 May 2015.
Myers, Martin G. et al. ‚Challenges And Opportunities Of Defining Clinical Leptin Resistance‘. Cell Metabolism 15.2 (2012): 150-156. Web.
Olofsson, L. E. et al. ‚Modulation Of Agrp-Neuronal Function By SOCS3 As An Initiating Event In Diet-Induced Hypothalamic Leptin Resistance‘. Proceedings of the National Academy of Sciences 110.8 (2013): E697-E706. Web.
Ozcan, Lale et al. ‚Endoplasmic Reticulum Stress Plays A Central Role In Development Of Leptin Resistance‘. Cell Metabolism 9.1 (2009): 35-51. Web.
Pekny, Milos, Ulrika Wilhelmsson, and Marcela Pekna. ‚The Dual Role Of Astrocyte Activation And Reactive Gliosis‘. Neuroscience Letters 565 (2014): 30-38. Web.
Rangroo Thrane, Vinita et al. ‚Ammonia Triggers Neuronal Disinhibition And Seizures By Impairing Astrocyte Potassium Buffering‘. Nat Med 19.12 (2013): 1643-1648. Web.
Saper, Clifford B., Thomas C. Chou, and Joel K. Elmquist. ‚The Need To Feed: Homeostatic And Hedonic Control Of Eating‘. Neuron 36.2 (2002): 199-211. Web.
Thaler, Joshua P. et al. ‚Obesity Is Associated With Hypothalamic Injury In Rodents And Humans‘. Journal of Clinical Investigation 122.1 (2012): 153-162. Web.
Thaler, Joshua P., and Michael W. Schwartz. ‚Minireview: Inflammation And Obesity Pathogenesis: The Hypothalamus Heats Up‘. Endocrinology 151.9 (2010): 4109-4115. Web.
Turek, Victoria F. et al. ‚Mechanisms Of Amylin/Leptin Synergy In Rodent Models‘. Endocrinology 151.1 (2010): 143-152. Web.
van der Velde, P, I Koslowsky, and H.S. Koopmans. ‚Measurement Of Gastric Emptying During And Between Meal Intake In Free-Feeding Lewis Rats‘. American Journal of Physiology 267.2 (1999): 597-605. Web. 26 May 2015.
Zhang, Yiying et al. ‚Positional Cloning Of The Mouse Obese Gene And Its Human Homologue‘. Nature 372.6505 (1994): 425-432. Web.

4 comments On Leptinresistenz und Hungerprobleme mit dieser Frucht überwinden?
Es ist großartig, wie du komplexe genetische Konzepte auf verständliche Weise erläuterst und praktische Ratschläge gibst. Deine Expertise auf diesem Gebiet ist beeindruckend, und ich bin dankbar für die wertvollen Informationen, die ich aus deinem Beitrag gewonnen habe.
Liebe Grüße,
Martin
„Kind, iss‘ deinen Teller leer“, „Iss’mal ordentlich, dass du groß und stark wirst“ – kennen wir alle sicherlich. Und wenn ich an mir herabschaue…. Könnten also diese Sprüche dahin führen, dass die Botschaft des Leptins (=satt) uminterpretiert wird in „es passt noch was rein“! (z. B. „Nachtisch geht immer“). Könnte dann eine Art Rekalibrieriung helfen, d. h. nur dann/ sobald essen, wenn man Hunger spürt und frühzeitig wieder aufhören?
Kaufen würde ich das nicht! Selbst die Hokuspokus-Fraktion warnt vor unkontrollierter Einnahme aufgrund möglicher Nebenwirkungen oder unklarer Herstellung – und das will was heißen.
Weiß jemand, warum es von diesem Produkt nicht schon Produkte zum kaufen gibt? Ich finde gar nichts..
Der punkt was können eltern tun wäre sehr interessant.