Bachelorarbeit von Oliver Sesto
Wir freuen uns riesig über die Erlaubnis diese tolle Arbeit in unserem Blog veröffentlichen zu dürfen. Beim Lesen werden dir viele Punkte begegnen, die du in ähnlicher Form immer wieder auf unserer Seite findest.
Oliver hat es geschafft einen umfassenden Überblick über das Thema Kalorienrestriktion zu schaffen. Vor allem wenn du englische Studien scheust, wirst du an diesem ausführlichen Review deine Freude haben.
Über den Autor
 Oliver Sesto setzt sich seit zehn Jahren mit den Themen Ernährung, Bodybuilding und Kraftsport auseinander. Seit 2012 nimmt er erfolgreich an Bodybuilding Wettkämpfen teil und ist unter anderem Vize-Deutschermeister im Classic-Bodybuilding.
Oliver Sesto setzt sich seit zehn Jahren mit den Themen Ernährung, Bodybuilding und Kraftsport auseinander. Seit 2012 nimmt er erfolgreich an Bodybuilding Wettkämpfen teil und ist unter anderem Vize-Deutschermeister im Classic-Bodybuilding.
1 Einleitung
Die Lebenserwartung in den industrialisierten Ländern der Welt stieg in den letzten 160 Jahren kontinuierlich an. Lag die durchschnittliche Lebenserwartung bei Geburt am Anfang des 19. Jahrhunderts noch bei etwa 45 Jahren, so lag sie in Japan, dem Land mit der höchsten durchschnittlichen Lebenserwartung im Jahr 2009 für Frauen bei 86,5 Jahren (Doblhammer und Kreft 2011). Dieser Anstieg ist vor allem auf die Verbesserung der Lebensbedingungen, der Hygienebedingungen und den medizinischen Fortschritt zurückzuführen. Die durch diese Faktoren bedingte Verschiebung des durchschnittlichen Sterbealters in ein höheres Lebensalter führt zu einer Veränderung der häufigsten Todesursachen. Waren am Anfang des 20. Jahrhunderts noch Infektionskrankheiten die Haupttodesursache, sind es heute altersbedingte degenerative Erkrankungen, wie Erkrankungen des Herzkreislaufsystems und Krebs (Wilmoth 2000; Doblhammer und Kreft 2011). Während die Erforschung der einzelnen Erkrankungen durchaus Sinn macht um ihnen zu begegnen, könnte die Erforschung gemeinsamer Ursachen größere Erfolge versprechen. Das Altern selbst ist zwar keine Krankheit, stellt aber den größten Risikofaktor für diese altersassoziierten Erkrankungen dar. Durch ein tieferes Verständnis der Mechanismen des Alterns ließe sich die Entstehung dieser Krankheiten verlangsamen oder verhindern (Hayflick 2007). Eine Möglichkeit, die seit vielen Jahrzehnten untersucht wird, und die sich in vielen Spezies als wirksam erwiesen hat, das Altern zu verlangsamen, die Lebensdauer zu erhöhen und das Auftreten altersbedingter Erkrankungen zu verringern, ist die Kalorienrestriktion (Masoro 2005). Eine einfache Restriktion der Nahrung in ihrer Gesamtkalorienanzahl, die aber dennoch die essentiellen Nährstoffe deckt, kann wichtige Erkenntnisse liefern, um die Prozesse des Alterns zu verstehen und damit dem Menschen neue Möglichkeiten zu geben dem Altern und den damit verbundenen Problemen zu begegnen.
Diese Arbeit beschäftigt sich primär mit der Kalorienrestriktion, ihren Auswirkungen auf die verschiedenen untersuchten Spezies und den verschiedenen Hypothesen zu den ihr zugrunde liegenden Mechanismen. Ziel der Arbeit ist es, einen Überblick über den Stand der Forschung der Kalorienrestriktion zu geben.
2 Überblick über das Altern
Das Phänomen des Alterns ist noch nicht vollständig erforscht und wird in verschiedenen Wissenschaftsdisziplinen untersucht. Für das Altern gibt es keine einheitliche Definition. Das Altern wird unter anderem als die zeitunabhängige Abfolge von sich anhäufenden, progressiven, intrinsischen und schädlichen strukturellen und funktionellen Veränderungen, die sich normalerweise ab der Phase der Reproduktionsreife manifestieren und eventuell im Tod gipfeln, definiert (Arking 2006, S. 11).
2.1 Alternstheorien
Evolutionäre Theorien des Alterns versuchen, die biologischen Entwicklungsprozesse und die Entwicklung des Alterns durch das Zusammenspiel aus den Prozessen der Mutation und Selektion zu erklären (Ljubuncic, Reznick 2009). Sie beschäftigen sich mit den Ursachen des Alterns und den Gründen für die Unterschiede in der Lebensdauer zwischen den verschiedenen Spezies (Kirkwood und Austad 2000). Die drei bekanntesten evolutionären Theorien des Alterns sind:
- Die Mutations-Akkumulations-Theorie von Medawar (1952). Sie besagt, dass Altern als Nebenprodukt der Selektion entsteht. Im Laufe des Lebens kommt es zu Mutationen in Genen, die im späteren Lebensalter negative Auswirkungen auf das Überleben haben. Nach dem Ende der Reproduktionsphase unterliegen diese Mutationen einem geringeren Selektionsdruck, weil sie dann nicht mehr ausselektiert werden.
- Die Theorie der antagonistischen Pleiotropie von Williams (1957), die auf der Mutations-Akkumulations-Theorie aufbaut. Diese Theorie besagt, dass Gene existieren, die mehrere Funktionen besitzen können (pleiotrop). So kann ein Gen, das in einer frühen Lebensphase positive Auswirkungen auf das Überleben hat und deshalb nicht ausselektiert wird, sich in späteren Lebensphasen negativ auf das Überleben auswirken.
- Die Disposable-Soma-Theorie von Kirkwood (1977), die postuliert, dass die begrenzten Energieressourcen zwischen Reproduktionsfähigkeit und Überleben des Organismus aufgeteilt werden. Das Überleben eines Individuums ist aber nur wichtig für das Überleben der Spezies, solange es sich fortpflanzen kann. Deswegen wird Energie nur solange in die Instandhaltungs- und Reperaturmechanismen des Organismus investiert, wie es für den Reproduktionserfolg nötig ist.
Es existieren viele weitere Theorien, die versuchen einen zugrunde liegenden Prozess zu finden, der das Altern erklären kann. Diese Alternstheorien lassen sich z. B. nach den verschiedenen Ebenen einteilen, auf denen altersbedingte Veränderungen zu beobachten sind. Altersbedingte Veränderungen lassen sich auf der Ebene der Moleküle, der Organelle, der Zelle, der Organe oder des gesamten Körpers beobachten (Hayflick 1985).
Eine andere, häufig verwendete, Einteilung der Alternstheorien ist die Einteilung in Programm-Theorien und Fehler-Theorien. Die Programm-Theorien besagen, dass das Altern abhängig von einer „biologischen Uhr“ ist, die die Lebensdauer reguliert. Diese Regulation findet durch Gene statt, die verantwortlich für die Aufrechterhaltung der Homöostase des Nerven-, Hormon- und Immunsystems und für die Aktvierung von Abwehrsystemen sind. Fehler-Theorien machen die schädlichen äußeren Einflüsse auf den Organismus, die zu progressiven Schäden auf verschiedenen Ebenen (z. B. Schäden an der mitochondriellen DNA, Ansammlung von freien Radikalen, Kreuzvernetzungen von Proteinen) führen, für das Altern verantwortlich. Eine Auswahl von Alternstheorien, eingeteilt in Fehler- und Programm-Theorien, sind in der Tabelle 2.1.1 zusammengefasst (Weinert und Timiras 2003).
Tab. 2.1.1: Übersicht über einige ausgewählte Theorien des Alterns, zusammengefasst aus (Armbrecht 2001; Weinert und Timiras 2003) und (modifiziert nach Dice 1993).
| Fehler-Theorien | Beschreibung |
| „Rate of living“ | Lebensdauer eines Organismus ist abhängig von seiner Stoffwechselrate |
| Ansammlung von Abfallprodukten | Anreicherung von Abfallprodukten (z. B. oxidierte Proteine, Lipofuscin) des Stoffwechsels in der Zelle führt zu einem Verlust an Funktionsfähigkeit |
| somatische Mutationen | Durch somatische Mutationen kommt es zu Veränderungen an genetischen Informationen |
| „Cross-linking“ | Kreuzvernetzung von Makromolekülen (z. B. DNA, Proteine) beeinträchtigt ihre Funktion |
| Oxidative Schädigung | Oxidative Schäden durch reaktive Verbindungen (z. B. freie Radikale) an Proteinen, Lipiden, DNA |
| Fehler-Katastrophen | Fehler bei der Proteinsynthese (Transkription und Translation) mit der Folge der Ansammlung von fehlerhaften Proteinen |
| Programm-Theorien | Beschreibung |
| Neuroendokrine Theorie | Veränderungen in der neuroendokrinen Homöostase führt zu altersbedingten physiologischen Veränderungen |
| Immunologische Theorie | Abnahme der Immunfunktion im Alter führt zu einer geringeren Widerstandsfähigkeit gegen Infektionskrankheiten und einem erhöhten Auftreten von Autoimmunität |
| Zelluläre Seneszenz-Telomer Theorie | Phänotyp des Alterns kommt durch einen erhöhtes Vorkommen an seneszenten Zellen, die durch den Verlust der Telomere (replikative Seneszenz) oder durch Zellstress (zelluläre Seneszenz) entstehen, zustande |
Die Sicht auf das Altern hat sich aber in den letzten Jahren verändert. Heute sieht man das Altern als einen sehr komplexen und multifaktoriellen Prozess an, und beschränkt sich nicht mehr auf die Suche nach einzelnen Gründen oder Prozessen für das Altern. Einzelne Prozesse können sich gleichzeitig gegenseitig beeinflussen und auf verschiedenen Ebenen des Körpers ablaufen. Einige der Alternstheorien könnten durchaus alleine oder in der Kombination mit anderen Theorien einige oder alle Merkmale des Alterns beschreiben (Weinert und Timiras 2003).
2.2 Molekulare Prozesse des Alterns
Anhand der in Kapitel 2.1 besprochenen Vielzahl an Alternstheorien wird deutlich, dass das biologische Altern ein sehr komplexes und multifaktorielles Geschehen ist. Altersbedingte Veränderungen eines Organismus, sowohl die äußerlichen sichtbaren Merkmale wie z.B. das Ergrauen der Haare oder der Verlust an Hautelastizität beim Menschen, als auch die Funktionsverluste, die mit der Zeit zu Krankheiten führen können, sind letztendlich auf Prozesse auf molekularer und zellulärer Ebene zurückzuführen (Rensing und Rippe 2013, S. 54-68). Ein Organismus stellt somit ein System dar, in dem alle in ihm ablaufenden Prozesse sich wechselseitig beeinflussen, aber nicht jede Veränderung im Zusammenbruch des gesamten Systems endet. Ein Organismus ist kein geschlossenes System, sondern interagiert ständig mit seiner Umwelt. Um der Tatsache gerecht zu werden, dass sich auch äußere Einflüsse auf den Organismus und auf das Altern auswirken, kann man eine Aufteilung in primäres und sekundäres Altern vornehmen. Das primäre Altern entspricht der zuvor beschriebenen Definition des Alterns, also den sich anhäufenden, intrinsischen, progressiven und schädlichen Veränderungen. Wohingegen das sekundäre Altern die beschleunigten Struktur- und Funktionsverluste durch äußere Einflüsse wie Krankheiten oder schädliche Umwelt- oder Lebensstilfaktoren beschreibt (Fontana und Klein 2007).
Auch wenn die genauen Mechanismen, die dem primären und dem sekundären Altern zugrunde liegen, noch nicht genau bekannt sind, gibt es einige Faktoren, die nach bisherigem Wissenstand das Altern bestimmen. Oxidative Schäden an der DNA, Proteinen und Lipiden und vor allem Schäden an den Mitochondrien, Gendefekte, die zu verringerten Reparatur- und Instandhaltungsmechanismen der Zellen führen, und die Verkürzung der Chromosomenenden (Telomere) können als die wichtigsten angesehen werden (Rensing und Rippe 2013, S.47-48). Nach Fontana und Klein (2007) lassen sich die Faktoren wie folgt zusammenfassen:
- durch oxidativen Stress bedingte Schäden an Proteinen und der DNA in Verbindung mit einer unzureichenden Reparatur dieser Schäden;
- genetische Instabilitäten des mitochondrialen und nuklearen Genoms;
- nicht durch Infektionen bedingte chronische Entzündungen, die durch eine erhöhte Produktion von Adipokinen und Cytokinen zustande kommen;
- Veränderungen im Fettsäurestoffwechsel, darunter eine exzessive Freisetzung von freien Fettsäuren ins Plasma, die zu einer Insulinresistenz von Geweben führt;
- Ansammlung von Abfallprodukten des Stoffwechsels in den Zellen wie Advanced Glykation Endproducts (AGE), Amyloid und Proteine, die die normale Zellfunktion behindern;
- Aktivierung des sympathischen Nervensystems und des Angiotensin-Systems, sowie Veränderungen im neuroendokrinen System;
- der Verlust an postmitotischen Zellen, der zu einer verringerten Anzahl an Neuronen und Muskelzellen sowie zu einer allgemeinen Verschlechterung in der Struktur und Funktion von Zellen aller Gewebe und Organe führt.
Das Altern selbst ist keine Krankheit aber erhöht die Anfälligkeit für Krankheiten (Hayflick 2007). Das Altern und damit die eben genannten ursächlichen Faktoren gelten als die bedeutendsten Risikofaktoren für altersbedingte Krankheiten. Diese Tatsache führt zu dem Schluss, dass es eine grundlegende Gemeinsamkeit in der Entstehung altersbedingter Krankheiten gibt, auch wenn diese sich unterschiedlich manifestieren (Partridge 2010).
3 Kalorienrestriktion
In den letzten 80 Jahren hat sich die Forschung im Bereich der Kalorienrestriktion zu einem bedeutenden Forschungsbereich entwickelt. Ausgelöst wurde das Interesse an der Kalorienrestriktion durch eine Studie von McCay und Kollegen aus dem Jahre 1935. Sie zeigten, dass Ratten, die eine reduzierte Menge an Futter erhielten, länger lebten (McCay et al. 1935). Ähnliche Ergebnisse konnten in folgenden Untersuchungen an verschiedenen Ratten- und Mausstämmen, aber auch an diversen anderen Organismen, darunter Hefen, Würmern, Fliegen, Fischen, Hamstern und Hunden bestätigt werden (Masoro 2002). Studien über die Wirkung der Kalorienrestriktion bei Rhesusaffen lieferten kontroverse Ergebnisse (Colman et al. 2014).
3.1 Definition
Unter Kalorienrestriktion (KR) versteht man eine Ernährungsweise, die eine Restriktion der Energieaufnahme vorsieht, aber dennoch den Bedarf an essentiellen Nährstoffen deckt (Cerqueira und Kowaltowski 2010).
Es existieren viele verschiedene Verfahren der KR, die sich in der Art ihrer Durchführung unterscheiden. Das Standardverfahren bei Nagetieren ist ein uneingeschränkter Zugang zu Futter (ad libitum, AL) der Kontrollgruppe. Die von der Kontrollgruppe verzehrte Menge an Futter wird erfasst und die Restriktionsgruppe erhält nur einen Teil, meistens 60 – 80 % dieser Menge (Piper und Bartke 2008). Eine Modifikation dieses Verfahrens ist eine leichte Restriktion der Kontrollgruppe um 5 – 15 % der durchschnittlichen AL gefütterten Menge. Dadurch sollen Übergewicht und dessen negative Folgen auf die Gesundheit der Kontrolltiere vermieden werden (Pugh et al. 1999). Es gibt auch sehr aufwendige Methoden der KR, bei denen für jedes Tier individuell die aufgenommene Nahrungsmenge unter AL Fütterung ermittelt wird und dann eine Restriktion erfolgt. Diese Methode wurde z. B. in einer der Primatenstudien angewandt (Kemnitz et al. 1993). Bei Invertebraten unterscheiden sich die Verfahren der KR von den zuvor genannten. Bei Hefen, Würmern und Fliegen wird eine KR meistens durch eine Verdünnung des Nährmediums, das durchgängig zur Verfügung steht, erreicht (Speakman und Mitchell 2011). Bei dem Fadenwurm Caenorhabditis elegans (C. elegans) gibt es neben der Verdünnung des Nährmediums noch weitere Verfahren, wie z. B. eine genetische Mutation von eat-2, die die pharyngale Funktion herunterreguliert und dadurch zu einer verringerten Nahrungsaufnahme führt (Lakowski und Hekimi 1998). Um einen Mangel an Vitaminen und Mineralstoffen vorzubeugen, kann bei allen genannten Verfahren die Nahrung der Restriktionsgruppe zusätzlich mit diesen ergänzt werden (Pugh et al. 1999).
Bezüglich des ursächlichen Faktors für die Effekte der KR bestehen noch einige Unklarheiten in der Forschung. Viele Jahre galt es als gesichert, dass die reduzierte Menge an Energie (Kalorien) für die Effekte der KR verantwortlich ist. Bei Untersuchungen mit anderen Nahrungsinterventionen an verschieden Modellorganismen konnten jedoch ähnliche Effekte, wie die der KR, gefunden werden. Eine Restriktion des Nahrungsproteins, der essentiellen Aminosäure Methionin und alternierendes Fasten ohne eine Einschränkung der Kalorienaufnahme sind Beispiele für solche Nahrungsinterventionen (Taormina und Mirisola 2014). Eine Restriktion der Aminosäure Methionin hat bei Ratten und Mäusen ohne eine Einschränkung der Kalorienaufnahme zu einer signifikanten Verlängerung der Lebensdauer geführt (Orentreich et al. 1993; Zimmerman et al. 2003; Miller et al. 2005).
In der Literatur finden sich verschiedene Begriffe im Zusammenhang mit Interventionen, die die Nahrungszufuhr einschränken und die Lebensdauer verlängern. Oft wird der Begriff „dietary restriction“ anstelle von Kalorienrestriktion (caloric restriction) verwendet um zu verdeutlichen, dass auch andere Nahrungsbestandteile und nicht nur die reduzierte Kalorienzufuhr für die Effekte verantwortlich sein könnten (Sohal und Forster 2014). Masoro (2009) äußert Kritik an dem Begriff „dietary restriction“, da dieser auch bedeuten könnte, dass nur einzelne Nahrungsbestandteile reduziert werden. Deshalb schlägt er den Begriff „food restriction“ als Überbegriff vor. In dieser Arbeit werden bevorzugt Studien, die eine Restriktion der gesamten Nahrungszufuhr und somit eine Restriktion der Gesamtkalorien untersuchen, betrachtet. Somit wird im Folgenden ausschließlich der Begriff Kalorienrestriktion verwendet.
Aufgrund der kurzen Lebensdauer und der kostengünstigen und unkomplizierten Haltung werden für KR-Studien meistens Modellorganismen verwendet. Kurzlebige Spezies wie C. elegans (ca. 3 Wochen), die Taufliege Drosophila melanogaster (D. melanogaster) (ca. 3 Monate) und Ratten und Mäuse (ca. 3 Jahre) sind die am häufigsten verwendeten Modellorganismen (Piper et al. 2005; Gems und Partridge 2013). Studien an langlebigen Spezies, wie die an Rhesusaffen, sind mit einem großen Aufwand und hohen Kosten verbunden (Colman et al. 2014). Kontrollierte Langzeitstudien am Menschen können, aufgrund der langen Lebensdauer des Menschen, gesundheitlicher Aspekte und der Zumutbarkeit einer so strengen Nahrungsintervention kaum realisiert werden (Dirks und Leeuwenburgh 2006). Eine Möglichkeit dennoch Einblicke der Wirkung der KR auf den Menschen zu erhalten, sind Beobachtungen an den Einwohnern Okinawas, die in der Vergangenheit wahrscheinlich unter KR ähnlichen Bedingungen gelebt haben, oder an Menschen, die aus eigener Überzeugung eine KR praktizieren. Zusätzlich liegen Daten aus Kurzzeitstudien am Menschen vor, in denen die Auswirkungen einer KR untersucht wurden (Dirks und Leeuwenburgh 2006).
3.2 Auswirkungen auf die Lebensdauer
Eine lebenslange oder zumindest eine längerfristige KR konnte in diversen Tierspezies sowohl die mittlere, als auch die maximale Lebensdauer verlängern. Zur Analyse der Lebensdauer in KR-Studien werden Kohortensterbetafeln, die das Absterben eines Geburtenjahrgangs beschreiben, verwendet. In diesen werden Daten, die sich auf das Alter und die Mortalität der Gruppe beziehen, gesammelt und in gesetzte Altersintervalle eingeteilt. Bei Studien an Ratten oder Mäusen werden für die Intervalle meist Monatsabstände gewählt. Mit den gesammelten Daten lässt sich z. B. die altersspezifische Mortalitätsrate (der prozentuale Anteil einer Gruppe, der am Anfang eines Altersintervalls noch am Leben war und während des Intervalls gestorben ist) bestimmen. Die Daten lassen sich dann graphisch in der Form von Überlebenskurven darstellen (Masoro 2002, S.12-14; Speakman und Mitchell 2011).
Die mittlere Lebensdauer beschreibt die Lebensdauer, nach der noch 50 % der untersuchten Gruppe am Leben ist. Der Begriff maximale Lebensdauer beschreibt normalerweise das älteste bekannte Exemplar einer Art (Rensing und Rippe 2013, S. 2-3). Jedoch wird der Begriff maximale Lebensdauer im Rahmen der KR-Studien anders definiert. Sie beschreibt dann die durchschnittliche Lebensdauer der 10 % am längsten lebenden Individuen (Yu et al. 1985; Metaxakis und Partridge 2013). Ein Anstieg der mittleren Lebensdauer ist nicht unbedingt ein Indiz dafür, dass sich Alterungsprozesse verlangsamen. Ein Rückgang der Sterbefälle in frühen Lebensphasen führt z. B. zu einem Anstieg der mittleren Lebensdauer. Ein Anstieg der maximalen Lebensdauer hingegen lässt auf eine Verlangsamung von Alterungsprozessen schließen (Masoro 2002, S. 12-16). Die lebensverlängernden Effekte der KR fallen je nach Spezies und verwendetem Ernährungsprotokoll unterschiedlich aus. In Tabelle 3.2 1 sind Werte für das Ausmaß der Lebensverlängerung durch verschiedenen Verfahren der KR an verschiedenen Organismen dargestellt.
Tab. 3.2.1: Die prozentuale Erhöhung der Lebensdauer durch verschiedene Verfahren der KR bei unterschiedlichen Organsimen (modifiziert nach Mair und Dillin 2008).
| Spezies | Verfahren der KR | Art der gemessenen Lebensdauer | Anstieg der Lebensdauer
In Prozent |
| S. cerevisiae | Verdünnung der Glukose | RLS | 75 % |
| Vom Standard Nährmedium in Wasser | durchschnittliche CLS | 300 % | |
| C. elegans | eat-2 (ad1113) Mutation | durchschnittliche Lebensdauer | 46 % |
| Bakterienfreies Nährmedium | durchschnittliche Lebensdauer | 85 % | |
| Verdünnung des bakteriellen Nährmediums | durchschnittliche Lebensdauer | 52 % | |
| Reduktion von bakteriellen Peptonen | durchschnittliche Lebensdauer | 30 % | |
| Nahrungsentzug in der adulten Phase | durchschnittliche Lebensdauer | 50 % | |
| D. melanogaster | Reduktion der Hefepaste im Nährmedium | durchschnittliche Lebensdauer | 28 % |
| Verdünnung der Nährmediums | Mittlere Lebensdauer | 66 % | |
| Mittelmeer Fruchtfliege | Verdünnung der Nährstoffe | Mittlere Lebensdauer | 22 % |
| Grashüpfer | Reduktion von 40 % der AL gefütterten Menge | Mittlere Lebensdauer | 62 % |
| Spinnen | Reduktion in der Anzahl der gefütterten Fliegen | Mittlere Lebensdauer | 212 % |
| Wasserläufer | Reduktion in der Anzahl der gefütterten Fliegen | Anstieg der Lebensdauer | 20 Tage |
| Wasserflöhe | Verdünnung des Nährmediums | durchschnittliche Lebensdauer | 69 % |
| Rädertierchen | Algen Entzug | durchschnittliche Lebensdauer | 60 % |
| Guppie | Reduzierte Menge an Würmern | Maximaleᵇ
Lebensdauer |
Nicht berichtet |
| Hamster | Reduktion des Futters um 50 % | Mittlere Lebensdauer | 30 % |
| Mäuse | AL versus 40kcal/Woche ab der Entwöhnung | durchschnittliche Lebensdauer | 65 % |
| Mit dem Alter von einem Jahr, 160kcal versus 90kcal/Woche | durchschnittliche Lebensdauer | 20 % | |
| Ratten | Reduktion der AL gefütterten Menge um 60 % | Mittlere Lebensdauer | 47 % |
| Hunde | Reduktion von 25 % der Futtermenge der Kontrolltiere | Mittlere Lebensdauer | 16 % |
Anmerkung: ᵃ CLS, chronological life span; RLS, replicative life span; AL, ad libitum; KR, Kalorienrestriktion.
ᵇ Die maximale Lebensdauer beschreibt die mittlere Lebensdauer der 10% der am längsten lebenden Tiere.
Das Ausmaß der lebensverlängernden Effekte hängt auch mit der Höhe der Restriktion zusammen. In Nagetierstudien, die unterschiedliche Höhen der KR untersuchten, konnte ein linearer Zusammenhang zwischen der Höhe der Restriktion und der verlängerten Lebensdauer beobachtet werden (Abb. 3.2.1). Der maximale Zugewinn an Lebensdauer der KR-Gruppe gegenüber der Kontrollgruppe lag bei etwa 50 %, bei einer KR um 60 % unter der Futtermenge der Kontrollgruppe. Eine KR um 30 % brachte hingegen nur einen Zugewinn an Lebensdauer von durchschnittlich 20 % (Abb.) (Speakman und Hambly 2007).
Abb. 3.2.1: Die Auswirkungen der KR auf die Lebensdauer (als prozentuale Erhöhung der Lebensdauer gegenüber der Kontrollgruppe) in Relation zur Höhe der KR (als prozentuale Reduktion der Kalorienzufuhr gegenüber der Kontrollgruppe), zusammengefasst aus Studien an Ratten und Mäusen (modifiziert nach Speakman und Hambly 2007).
Neben der Höhe der Restriktion hat auch der Zeitpunkt, zu dem mit der KR begonnen wird einen Einfluss auf die Verlängerung der Lebensdauer. In den meisten KR-Studien an Nagetieren und anderen Organismen wird sehr früh, meist direkt nach der Entwöhnung mit der KR begonnen und diese bis zum Lebensende fortgeführt. Für den Menschen haben diese Studien wenig Aussagekraft, da eine KR in einer so frühen Lebensphase für den Menschen aus gesundheitlichen und ethischen Gründen nicht möglich ist. Deshalb wurde an verschiedenen Organismen untersucht, wie sich die KR, wenn sie erst in einer späteren Lebensphase begonnen wird, auswirkt. Die Ergebnisse einiger dieser Studien sind für Nagetiere in Tabelle 3.2.2 zusammengefasst. Die Daten zeigen, dass die Verlängerung der Lebensdauer im Vergleich zu einer direkt nach der Entwöhnung begonnenen KR der gleichen Höhe im selben Stamm und unter ansonsten gleichen Bedingungen umso geringer ist, je später mit der KR begonnen wird(Merry 2002; Speakman und Hambly 2007).
Tab. 3.2.2: Die beobachteten Auswirkungen einer erst später begonnenen KR auf die Lebensdauer von Nagetieren in Relation zu einer, nach der Entwöhnung begonnenen, KR desselben Stammes und gleicher Höhe der KR ¹ (modifiziert nach Speakman und Hambly 2007).
| Spezies | Stamm | Verstrichene Lebensdauer zu Beginn der KR (%)1 | Zuwachs der Lebensdauer (%) im Vergleich zur KR direkt nach Entwöhnung2 |
| Maus | B103Hf1
B6C3f1 C57BL6 C57BL6 |
41 %
62 % 41 % 48 % |
33 %
38 % 55 % 52 % |
| Ratte | F344
Long Evans F344xBN f1 F344xBN f1 |
19 %
57 % 52 % 76 % |
67 %
0 % 0 % 0 % |
Anmerkung: ¹ ist der prozentuale Anteil der schon verstrichenen Lebensdauer zu Beginn der KR. ²ist der prozentuale Anstieg der Lebensdauer bei späterem Beginn der KR gegenüber dem Anstieg der Lebensdauer bei Beginn der KR nach der Entwöhnung.
Die Auswirkungen einer KR auf die Lebensdauer variieren auch bei verschiedenen Genotypen innerhalb einer Spezies. In einigen Studien konnte keine oder eine verkürzte Lebensdauer unter KR festgestellt werden (Harrison und Archer 1987; Turturro et al. 1999). Eine KR bei Nachkommen von Wildtyp Mäusen führte zu keiner Verlängerung der mittleren Lebensdauer im Vergleich zur Kontrollgruppe (Harper et al. 2006). Liao et al. (2010) untersuchten in einer Studie die Auswirkungen einer KR um 40 % auf die Lebensdauer von 41 verschiedenen rekombinanten Maus-Inzuchtstämmen. Sie konnten zeigen, dass eine gleiche Restriktionshöhe zu sehr unterschiedlichen Auswirkungen auf die Lebensdauer zwischen den einzelnen Stämmen führte. Eine KR führte in mehr Stämmen zu einer verringerten als zu einer verlängerten Lebensdauer.
3.3 Physiologische Effekte
Die in Tierexperimenten beobachteten Auswirkungen der KR beschränken sich nicht nur auf eine verlängerte Lebensdauer. Die verlängerte Lebensdauer resultiert vielmehr aus den umfassenden Auswirkungen der KR auf den gesamten Organismus. So können die Auswirkungen der KR auf allen Ebenen des Organismus beobachtet werden, von der Regulation einzelner Gene bis hin zu ganzen Organsystemen (Speakman und Mitchell 2011).
3.3.1 Modellorganismen
Wirbellose Modellorganismen wie Saccharomyces cerevisiae (S. cerevisiae), C. elegans und D. melanogaster sind auf Grund ihrer kurzen Lebensdauer und des einfachen Aufbaus besser für die Analyse der molekularen Mechanismen der KR geeignet. Sie unterscheiden sich metabolisch, anatomisch, physiologisch und auf Grund ihrer sehr kurzen Lebensdauer enorm von den Säugetieren (Omodei und Fontana 2011). Auch auf der Ebene molekularer Signalwege gibt es Unterschiede zwischen Säugetieren und den genannten Modellorganismen. Eine ähnliche Veränderung der Aktivität der Signalwege kann sich aufgrund der unterschiedlichen Physiologie und Struktur sehr unterschiedlich auf den jeweiligen Organismus auswirken (Partridge 2010). Deswegen sind die an Säugetieren wie z. B. Ratten oder Mäusen beobachteten Auswirkungen der KR für den Menschen relevanter.
Daten von Studien an Nagetieren belegen, dass eine KR das Auftreten und den Verlauf von altersbedingten Krankheiten verlangsamt. Die Haupttodesursache von Nagetieren (im Labor) ist Krebs, und die KR hat sich als wirksam erwiesen, spontan entstandene, chemisch induzierte oder durch Strahlung induzierte Tumore in ihrem Wachstum zu hemmen. Auch eine chronische Nephropathie und eine Kardiomyopathie, die in Nagetieren die zweit häufigsten Todesursachen ausmachen, konnte durch KR verhindert werden. Zusätzlich wies die KR-Gruppe in einem ApoE-knockout-Mausmodell weniger arteriosklerotische Läsionen im Vergleich zur AL gefütterten Kontrollgruppe auf, die mehr fortgeschrittene und fibrotische Läsionen entwickelte. Diabetes, Autoimmunerkrankungen und respiratorische Erkrankungen konnten auch durch KR verhindert werden. Zusätzlich führte eine KR an Tiermodellen für die Alzheimer-Krankheit, die Huntington-Krankheit und Schlaganfall zu verringerten Neurodegenerationen, β-Amyloid-Ablagerungen im Gehirn und verbesserter Neurogenese. Unter bestimmten Umständen konnten auch negative Auswirkungen einer langfristigen KR wie z. B. eine verringerte Wundheilung bei Mäusen festgestellt werden. Zusätzlich deuten einige Daten darauf hin, dass eine starke KR bei Mäusen, die in einer pathogen freien Umgebung leben, die Anfälligkeit für bakterielle und virale Infektionen erhöht (Omodei und Fontana 2011).
Neben dem verlangsamten Auftreten von altersbedingten Erkrankungen konnten auch noch zahlreiche weitere Auswirkungen der KR an Nagetieren beobachtet werden. Die Auswirkungen lassen sich nach Fontana und Klein (2007) wie folgt zusammenfassen:
(1) eine verringerte Produktion von reaktiven Sauerstoffverbindungen und eine Modulation der endogenen antioxidativen Systeme, welche den oxidativen Stress und die daraus resultierenden Gewebsschäden verringern;
(2) ein verringerter Spiegel an zirkulierendem Triiodthyronin (T₃) und eine verringerte Aktivität des sympathischen Nervensystems, was zu einer Abnahme der Körpertemperatur und des Grundumsatzes führt;
(3) eine verringerte Konzentration an entzündungsfördernden Zytokinen im Plasma und ein mäßiger Anstieg des Spiegels an zirkulierendem Kortisol, was zu einer Reduktion von Entzündungen im Körper führt;
(4) einen Schutz gegen altersassoziierte Verschlechterungen der Immunfunktion; und
(5) eine erhöhte Expression von Chaperonen, wie die Hitzeschockproteine 70 (HSP70) und neurotrophen Faktoren.
Weiterhin führt eine KR zu einer Abnahme der Plasmakonzentrationen an anabolen Hormonen und Wachstumsfaktoren, die an Prozessen des Alterns und der Tumorentstehung beteiligt sind. Zusätzlich beeinflusst eine KR viele Prozesse, die an Alternsprozessen beteiligt sind, darunter (1) gesteigerte DNA-Reparaturmechanismen; (2) erhöhte Entfernung von geschädigten zellulären Proteinen und oxidierten Lipiden; (3) verringerte Glykation von Proteinen und eine verringerte Bildung an AGEs; und (4) Abnahme an Kollagen-Kreuzvernetzungen. Viele Auswirkungen der KR kommen wahrscheinlich durch die Regulation der Genexpression zustande: Einerseits durch eine Hochregulation von Genen, die an zellulären Reparaturmechanismen, am Überleben, an der Stressresistenz und dem Schutz vor oxidativen Schäden beteiligt sind. Andererseits durch die Herunterregulation von Genen, die an der Entstehung von Entzündungen beteiligt sind. Weiterhin durch das Vermeiden von Veränderungen in der Genexpression, die mit dem Alter verbunden sind (Fontana und Klein 2007).
3.3.2 Rhesusaffen
Äußerlich sichtbare Merkmale des Alterns, die bei Menschen zu beobachten sind, lassen sich auch bei Rhesusaffen beobachten. Solche sind z. B. die Umverteilung des Körperfetts, das Ergrauen und Verdünnen der Haare und eine geringere Hautelastizität. Auch beim Menschen auftretende altersassoziierte Krankheiten und Störungen wie Diabetes, Neoplasien, Sarkopenie, Verlust an Knochenmasse und eine verringerte Immunfunktion lassen sich bei Rhesusaffen beobachten (Colman et al. 2014). Zwei verschiedene KR-Studien an Rhesusaffen werden seit dem Ende der 1990er Jahre durchgeführt: eine am National Institute of Aging (NIA) in Maryland und eine am Wisconsin National Primate Research Center (WNPRC).
Die WNPRC-Studie begann 1989 mit 30 männlichen Tieren und wurde 1994 um weitere 16 männliche und 30 weibliche Tiere erweitert. Seit 1994 fasst die Studie also 76 Rhesusaffen, die zu Beginn alle zwischen 8 und 14 Jahre alt waren (Colman et al. 2009). Die NIA-Studie begann 1987 mit 120 Rhesusaffen, davon 60 weiblich und 60 männlich. Die Tiere wurden nach dem Alter in zwei Gruppen unterteilt, eine mit sehr jungen, heranwachsenden und erwachsenen Tieren, im Alter zwischen 1 und 14 Jahren (young-onset), und eine mit älteren Tieren, im Alter zwischen 16 und 23 Jahren (old-onset) (Lane et al. 1997). Einige wichtige Daten zu den beiden Studien sind in Tabelle 3.3.2 1 zusammengefasst.
Die bisher veröffentlichten Daten der beiden Studien belegen, dass eine langfristige KR für Rhesusaffen realisierbar und sicher ist (Colman et al. 2014). Hinsichtlich der Auswirkungen liefern die Studien teilweise kontroverse Ergebnisse. Die KR-Gruppe der WNPRC-Studie zeigte eine um 50 % geringere Inzidenz für Krebs und kardiovaskuläre Erkrankungen im Vergleich zur Kontrollgruppe. Zusätzlich lagen in der KR-Gruppe keine Störungen des Glukosestoffwechsels oder Diabetes vor, dagegen entwickelten 5 von 38 der Kontrolltiere Diabetes und 11 zeigten Symptome eines Prädiabetes (Colman et al. 2009). Weitere Ergebnisse der WNPRC-Studie zeigten positive Auswirkungen einer KR auf die mit dem Alter auftretende Sarkopenie (Colman et al. 2008).
Bei der NIA-Studie gab es erhebliche Unterschiede bei der Auswirkung einer KR auf die young-onset und die old-onset Tiere. Positive Auswirkungen einer KR auf die Inzidenz von Krebs und Diabetes waren nur bei den young-onset Rhesusaffen zu beobachten. Kein Tier aus der KR-Gruppe wies Neoplasien auf, während in der Kontrollgruppe 6 Tiere Neoplasien aufwiesen und diese in fünf Fällen zum Tod führten. Eine verringerte Inzidenz an kardiovaskulären Erkrankungen durch eine KR wie bei der WNPRC-Studie konnte in der NIA-Studie nicht beobachtet werden (Mattison et al. 2012). Die größte Diskrepanz der beiden Studien liegt jedoch in der Auswirkung einer KR auf die Lebensdauer. Während die WNPRC-Studie bezogen auf altersbedingten Todesursachen einen signifikanten Effekt auf das Überleben der KR-Gruppe belegen konnte, konnte die NIA-Studie keinen signifikanten Unterschied im Überleben der KR-Gruppe im Vergleich zur Kontrollgruppe finden (Mattison et al. 2012; Colman et al. 2014).
Tab. 3.3.2.1: Einige Daten zu der WNPRC- und NIA-Studie an Rhesusaffen zusammengestellt aus Daten von (Colman et al. 2009; Mattison et al. 2012) und (modifiziert nach Lane et al. 1997).
| WNPRC-Studie | NIA-Studie | |
| Beginn der Studie und Anzahl der Tiere | 1989: 30 m
1994: + 16 m, 30 w |
1987: 60 m, 60 w |
| Alter der Tiere zu Beginn | 7-14 Jahre, alle erwachsen | Young-onset: 1 – 14 Jahre
Old-onset: 16 – 23 Jahre |
| Verfahren der KR | Kontrollgruppe:
AL Fütterung KR-Gruppe: 30% Restriktion der individuell bestimmten verzehrten Menge unter AL |
Kontrollgruppe: leicht begrenzte Fütterung
KR-Gruppe: 30% Restriktion |
| Unterbringung der Tiere | Einzeln gehalten | Einzeln gehalten |
| Herkunft der Tiere | Indien | Indien, China |
| Zusammensetzung der Nahrung | Teilweise verarbeitete Nahrungsbestandteile | Aus natürlichen Bestandteilen |
| Ergänzung mit Vitaminen und Mineralien | Nur die KR-Gruppe | + 40 % der täglichen empfohlenen Dosis für beide Gruppen |
Anmerkung: m = männlich, w = weiblich, AL = ad libitum, KR = Kalorienrestriktion.
Die teilweise gegenläufigen Ergebnisse der beiden Studien könnten in der unterschiedlichen Durchführung der Studien begründet liegen. Die NIA-Kontrollgruppe erhielt im Gegensatz zu der WNPRC-Kontrollgruppe keinen AL Zugang zu Futter, sondern wurde leicht eingeschränkt. Das könnte dazu geführt haben, dass die NIA-Kontrollgruppe bereits von einer leichten KR profitierte und deswegen keine Unterschiede im Vergleich zu der KR-Gruppe gefunden werden konnten. Ein weiterer Unterschied der beiden Studien ist die Zusammensetzung der Nahrung. Während die gefütterte Nahrung der NIA-Studie aus überwiegend naturbelassenen Nahrungsmitteln bestand und einen geringen Anteil an Zucker (3,9 %) enthielt, war die Nahrung der WNPRC-Studie aus industriell verarbeiteten Bestandteilen zusammengesetzt und enthielt einen höheren Anteil an Zucker (28,5 %) (Mattison et al. 2012). Die Nahrung der NIA-Studie enthielt somit auch sekundäre Pflanzenstoffe, die sich positiv auf die Gesundheit auswirken könnten (Si und Liu 2014). Auch die Ergänzung mit Vitaminen und Mineralien unterschied sich zwischen den beiden Studien. In der NIA-Studie wurde die Nahrung der Kontroll- und der KR-Gruppe ergänzt, in der WNPRC-Studie wurde lediglich die Nahrung der KR-Gruppe ergänzt. Auch die genetische Diversität der Rhesusaffen unterschied sich in den beiden Gruppen. Die Tiere der NIA-Studie stammen aus China und Indien, während die Tiere der WNPRC-Studie ausschließlich indische Wurzeln haben (Mattison et al. 2012; Colman et al. 2014).
Um die Daten in einen größeren Zusammenhang zu stellen, verglichen Colman et al. (2014) die Gewichtsdaten der Kontrollgruppen beider Studien mit Durchschnittswerten aus der internet Primate Research Database (iPAD). Die iPAD ist eine Datenbank, in der klinische und biometrische Daten von gesunden, nicht für Experimente genutzten, in Gefangenschaft lebenden nicht-menschlichen Primaten erfasst werden. Anzumerken ist jedoch, dass die Daten der iPAD nicht zwischen Einzel- oder Gruppenhaltung unterscheiden. Der Vergleich zeigte, dass bezogen auf jede Geschlechts- und Altersgruppe das Gewicht der Kontrolltiere der WNPRC-Studie über dem Durchschnitt und das der NIA-Kontrolltiere unter dem Durchschnitt lag (Abb. 3.3.2. 1). Sowohl Mattison et al. (2012) als auch Colman et al. (2014) vermuten, dass die nicht vorhandenen Unterschiede in der Lebensdauer der NIA-Tiere in der leicht eingeschränkten Fütterung der Kontrollgruppe begründet liegen und diese schon von der leichten Restriktion profitiert. Die Daten der Lebensdauer der old-onset Tiere der NIA-Studie sind konsistent mit dieser Erklärung. Die mittlere Lebensdauer sowohl der Kontroll- als auch der KR-Gruppe liegen mit 35,4 Jahren für männliche und 27,8 Jahren für weibliche Tiere über dem Durchschnittswert für die mittlere Lebensdauer von 27 Jahren für Rhesusaffen in Gefangenschaft (Mattison et al. 2012). Zusätzlich überschritten ein Tier aus der Kontrollgruppe und 4 Tiere aus der KR-Gruppe der old-onset Tiere ein Alter von 40 Jahren. Ein so hohes Alter erreichten nur 2 von 3264 Rhesusaffen in der iPAD. Dies zeigt, dass die Tiere der NIA-Studie außergewöhnlich lang leben (Colman et al. 2014).
Abb. 3.3.2.1: Vergleich des Körpergewichts der Kontrolltiere der WNPRC- (rot) und der NIA-(blau) Studie mit Durchschnittswerten von Tieren (gleichen Alters und Geschlechts) aus der iPAD. Dargestellt sind die prozentualen Abweichungen von den jeweiligen Durchschnittswerten (modifiziert nach Colman et al. 2014).
3.3.3 Mensch
Die vorliegenden Daten zur Auswirkung einer KR beim Menschen stammen aus epidemiologischen Studien an den Inselbewohnern Okinawas. Zusätzlich liegen Daten aus Studien vor, in denen zufällig eine KR zustande gekommen ist, wie dem Biosphere 2 Experiment und solchen, in denen Menschen aus eigener Überzeugung eine KR praktizieren. Auch randomisierte und kontrollierte Interventionsstudien wie das CALERIE-Projekt untersuchen eine KR am Menschen und liefern erste Ergebnisse.
Die Bewohner der Insel Okinawa hatten für viele Jahre eine höhere Lebenserwartung als die Menschen in den restlichen Gebieten Japans und eine hohe Rate an Hundertjährigen. Daten aus epidemiologischen Studien deuten darauf hin, dass die älteren Bewohner der Insel Okinawas für etwa die Hälfte ihres Lebens einer KR unterlagen. Die Bewohner Okinawas nahmen im Jahr 1972 im Vergleich zur japanischen Gesamtbevölkerung durchschnittlich nur etwa 83 % der Kalorien, aber dafür die dreifache Menge an Gemüse auf(Kagawa 1978). Willcox et al. (2007) untersuchten archivierte Daten der älteren Einwohner Okinawas (≥ 65 Jahre) aus 6 Jahrzehnten um herauszufinden, ob eine KR als Grund für die lange Lebensdauer der Einwohner Okinawas in Frage kommt. Sie fanden heraus, dass die Einwohner Okinawas vor 1960 ein Energiedefizit von etwa 11 % hatten, dieses sich aber mit Veränderungen der Essgewohnheiten über die Jahre verlor. Die heute älteren Bewohner Okinawas könnten somit eine längere Zeit unter KR gelebt haben. Ein Vergleich der Überlebenskurve der Populationen Japans, den USA und Okinawas aus dem Jahr 1995 zeigt eine höhere mittlere und maximale Lebensdauer für die Population Okinawas. Gleichzeitig war die auf das Alter angepasste Mortalität für altersbedingte Erkrankungen, vor allem für Herz-Kreislauf-Erkrankungen, der älteren Einwohner Okinawas sehr gering im Vergleich zu Japanern und Amerikanern gleichen Alters. Aus dieser Korrelation kann aber keinesfalls auf eine Kausalität zwischen einer verringerten Kalorienaufnahme und erhöhter Lebensdauer bzw. geringerer Mortalität an altersbedingten Erkrankungen geschlossen werden.
Das Biosphere 2 Experiment hatte ursprünglich den Zweck, ein von der Außenwelt unabhängiges, sich selbst erhaltendes Ökosystem zu erschaffen und zu untersuchen, ob ein langfristiges Leben darin möglich ist. Je vier Männer und Frauen, sieben davon im Alter zwischen 27 und 42 Jahren, lebten zwei Jahre lang in der Biosphere 2. Aufgrund unzureichender Anbaumöglichkeiten für Lebensmittel lebten sie die meiste Zeit unter KR ähnlichen Bedingungen (1750 – 2100 kcal/Tag) mit zusätzlicher hoher körperlicher Aktivität. Die Ernährungsweise war größtenteils vegetarisch und der größte Teil der täglichen Kalorien wurde in Form von Kohlenhydraten aus Obst, Gemüse und anderen Stärketrägern wie Reis oder Weizen aufgenommen. Ein Teil der Mikronährstoffe wurde ergänzt. Beobachtete Auswirkungen waren unter anderem: (1) eine Reduktion des Köpergewichts und eine damit verbundene Abnahme des Body-Mass-Index (BMI) im Vergleich zum Anfangswert von durchschnittlich 19 % bei den Männern und 13 % bei den Frauen; (2) eine Abnahme des systolischen und diastolischen Blutdrucks; (3) eine Abnahme des Blutzucker- und des Insulinspiegels (nüchtern); (4) eine Abnahme des T₃-Spiegels im Serum; (5) eine Abnahme des Cholesterolspiegels; (6) eine Abnahme der Anzahl an weißen Blutkörperchen; und (7) eine Abnahme der Körpertemperatur (Walford et al. 2002).
Eine weitere Möglichkeit, die Auswirkungen einer langfristigen KR beim Menschen zu untersuchen, sind Studien an Menschen, die aus eigener Überzeugung eine KR praktizieren. Im Jahr 1994 gründete eine Gruppe von Personen, die in der Hoffnung auf ein langes Leben und gesundheitliche Vorteile eine KR praktizieren, die Caloric Restriction Society (CR-Society) (Speakman und Mitchell 2011; Fontana et al. 2006). Fontana et al. (2004) untersuchten die Auswirkungen einer KR auf das Arteriosklerose-Risiko an 18 Mitgliedern der CR-Society mit einem Durchschnittsalter von 50,3 ± 10 Jahren, die durchschnittlich 6 Jahre lang eine KR praktizierten und 18 gleichaltrigen, gesunden Personen, mit einer typisch amerikanischen Ernährungsweise. Die Daten zeigten umfassende und nachhaltig positive Auswirkungen der KR auf die Hauptrisikofaktoren für Arteriosklerose wie den Gesamtcholesterin-, das LDL-Cholesterin-, HDL-Cholesterin-, Triglyceridspiegel und den Blutdruck, die normalerweise mit dem Älterwerden ansteigen. Zusätzlich konnte gezeigt werden, dass eine KR eine protektive Wirkung gegenüber Übergewicht und Insulinresistenz hat. Weiterhin deutet ein verringerter Entzündungsmarker, das C-reaktive Protein (CRP), auf weniger Entzündungsprozesse unter KR hin. Meyer et. al (2006) konnten in einer weiteren Studie mit 25 Mitgliedern der CR-Society mit einem Durchschnittsalter von 52,7 ± 11,9 Jahren zeigen, dass sich eine langfristige KR positiv auf die linksventrikuläre diastolische Funktion, die normalerweise mit dem Alter abnimmt, auswirkt. Die Werte der diastolischen Funktion der Mitglieder der CR-Society waren vergleichbar mit Durchschnittswerten von 16 Jahre jüngeren Personen. Es muss jedoch erwähnt werden, dass solche nicht randomisierte Querschnittsstudien lediglich Hinweise für mögliche Auswirkungen einer KR auf den Menschen liefern und keine kausalen Schlüsse zulassen (Meyer et al. 2006).
Mehrere kontrollierte und randomisierte Interventionsstudien zur Auswirkung einer KR um 20 – 25 % an leicht übergewichtigen (BMI von 25 – 29,9 kg/m²) Personen wurden bereits durchgeführt. Diese waren Teil eines Forschungsprogrammes mehrerer Forschungszentren und liefen unter dem Namen Comprehensive Assesment of Long-Term Effects of Reducing Calorie Intake (CALERIE). In der ersten Phase des CALERIE-Projekts wurden über einen Zeitraum von 6 – 12 Monaten Studien mit übergewichtigen Probanden durchgeführt, um zu untersuchen, ob eine KR beim Menschen realisierbar ist und um erste Ergebnisse einer KR am Menschen unter kontrollierten Bedingungen zu erhalten. Es konnten metabolische und physiologische Veränderung beobachtet werden, die auch schon aus Tierexperimenten berichtet wurden. Als Veränderungen ließen sich eine Abnahme des viszeralen Fettgewebes und des Körperfettgehalts, ein verringertes Körpergewicht, eine Abnahme der Insulinresistenz und eine erhöhte Insulinsensitivität, eine Abnahme der Körpertemperatur und des Gesamtenergieverbrauchs, niedrige T₃-Spiegel im Serum, niedrige Spiegel an Entzündungsmarkern und Markern für oxidativen Stress messen (Fontana und Klein 2007; Holloszy und Fontana 2007). Weiterhin konnte in einer der Studien eine verringerte Knochenmasse und eine Abnahme an Muskelmasse und Muskelkraft gefunden werden, eine Kontrollgruppe dieser Studie, die Gewicht durch Sport abnahm, zeigte hingegen keine verringerte Knochenmasse(Villareal et al. 2006).
Die Probanden der ersten Phase des CALERIE-Projekts hatten am Ende der Studien immer noch einen BMI im oberen normalen oder leicht übergewichtigen Bereich. Eine langfristige KR führt aber meistens zu einem sehr niedrigen Körperfettgehalt und einem BMI im unteren Normalbereich. Deshalb sind die Ergebnisse der ersten Phase des CALERIE-Projekts eher als Auswirkungen eines Gewichtsverlusts bei Übergewichtigen einzuordnen. In der zweiten Phase des CALERIE-Projekts werden die Auswirkungen einer KR vermehrt an normalgewichtigen Personen (BMI zwischen 22 – 28 kg/m²) und über einen längeren Zeitraum von zwei Jahren untersucht. Die Ergebnisse der zweiten Phase liegen zum jetzigen Zeitpunkt noch nicht vor, könnten aber relevantere Informationen zur Auswirkung einer langfristigen KR liefern (Holloszy und Fontana 2007; Stewart et al. 2013).
4 Hypothesen der Kalorienrestriktions-Mechanismen
Seit dem Beginn der Forschung im Gebiet der Kalorienrestriktion wurden viele Hypothesen aufgestellt, die versuchen den der KR zugrunde liegenden Mechanismus zu erklären. Als zugrunde liegende Mechanismen wurden unter anderem eine Retardierung des Wachstums, eine Reduktion des Körperfettanteils, eine Reduktion der Stoffwechselrate, eine Verringerung des oxidativen Stresses, eine gesteigerte Apoptose, eine gehemmte Apoptose, eine gesteigerte Autophagie, eine verringerte Inflammation, eine Reduktion der Körpertemperatur, eine erhöhte physische Aktivität, eine Reduktion des Plasmaspiegels an Glukose, eine verringerte Aktivität des Insulin-like growth factor 1 (IGF-1) Signalwegs, eine erhöhte Aktivität des IGF-1 Signalwegs, eine verringerte Aktivität des Insulin Signalwegs, eine erhöhte Aktivität des Insulin Signalwegs, eine verringerte Aktivität des Target of Rapamycin (TOR) Signalwegs und die Hormesis vorgeschlagen (zusammengefasst in Masoro 2005; Sinclair 2005; Masoro 2009). Bis heute ist der für die Wirkung der KR zugrunde liegende Mechanismus noch nicht bekannt, und keine der einzelnen Hypothesen wird vollständig durch die Studienlage unterstützt (Sinclair 2005; Masoro 2009). Einige populäre Hypothesen werden im Folgenden näher erläutert und anhand der Studienlage diskutiert.
4.1 Wachstumsretardierung
Die wahrscheinlich älteste Hypothese ist die der Wachstumsretardierung, die auf die in Kapitel 3 erwähnte Studie von McCay et al. (1935) zurückgeht. Sie konnten beobachten, dass Ratten, die kurz nach der Entwöhnung eine reduzierte Menge an Kalorien aufnahmen, eine höhere Lebensdauer und ein durchschnittlich geringeres Körper- und Organgewicht hatten als Ratten, die AL gefüttert wurden. Ein verzögertes Wachstum, das man auf die geringere Kalorienaufnahme der Tiere zurückführt, wurde als ursächlich für die Verlängerung der Lebensdauer angenommen. Zuspruch für die Hypothese kam von einer Studie von Barrows und Roeder (1965). Sie zeigten, dass eine KR um 50 % bei ausgewachsenen Ratten im Alter von 12 Monaten in keiner signifikanten Verlängerung der Lebensdauer resultierte. Im Vergleich zur AL-gefütterten Kontrollgruppe konnte eine kleine, aber bedeutsame Verringerung der mittleren Lebensdauer der KR-Gruppe beobachtet werden.
In weiteren Studien konnte jedoch eine signifikante Erhöhung der mittleren und maximalen Lebensdauer an adulten Nagetieren unter KR belegt werden (Ross 1972; Weindruch und Walford 1982; Yu et al. 1985). Z. B. konnten Weindruch und Walford (1982) zeigen, dass eine KR bei Mäusen im Alter von 12 Monaten zu einer Verlängerung der mittleren und maximalen Lebensdauer führt. Die Studie von Yu et al. (1985) untersuchte die Wirkung einer KR um 40 % an Ratten in verschiedenen Phasen des Wachstums. Es wurden vier Gruppen gebildet (siehe Tab. 4.1.1).
Tab. 4.1.1: Ernährungsprotokoll der Ratten und Aufteilung in Gruppen (modifiziert nach Yu et al. 1985)
| Gruppe | Zeit unter AL-Fütterung | Zeit unter KR um 40% |
| 1: Kontrollgruppe | Ab der 6. Lebenswoche bis zum Lebensende | Zu keiner Zeit |
| 2: KR über das ganze Leben | Zu keiner Zeit | Ab der 6. Lebenswoche bis zum Lebensende |
| 3: KR nur zu einer Phase des schnellen Wachstums | Ab dem 6. Lebensmonat bis zum Lebensende | Ab der 6- Lebenswoche bis zum 6- Lebensmonat |
| 4: KR im fast ausgewachsenen Stadium | Ab der 6. Lebenswoche bis zum 6. Lebensmonat | Ab dem 6. Lebensmonat bis zum Lebensende |
Die Kontrollgruppe hatte die geringste mittlere und maximale Lebensdauer, darauf folgte die Gruppe 3, die nur in der Phase des schnellen Wachstums unter KR lebte. Die Gruppe 2 und 4, die die längste Zeit ihres Lebens unter KR lebten, hatten die längste mittlere und maximale Lebensdauer. Interessanterweise war eine KR ab dem 6. Lebensmonat genauso effektiv, bezogen auf die Verlängerung der maximalen Lebensdauer, wie eine schon sehr früh begonnene KR (Abb. 4.1.1).
Abb. 4.1.1: Überlebenskurve für die Gruppen 1, 2, 3 und 4 (Anzahl je Gruppe: 40 Tiere), jeder Punkt repräsentiert ein Tier (modifiziert nach Yu et al. 1985).Anmerkung: 1: Kontrollgruppe, 2: KR über das ganze Leben, 3: KR nur zu einer Phase des schnellen Wachstums, 4: KR im fast ausgewachsenen Stadium
Die Ergebnisse aus den Studien von Ross (1972), Weindruch und Walford (1982) und Yu et al. (1985) sprechen gegen die Hypothese der Wachstumsretardierung, weil sie alle zeigen konnten, dass eine KR auch bei ausgewachsenen adulten Nagetieren zu einer Verlängerung der mittleren und maximalen Lebensdauer führt. Im Widerspruch dazu zeigten Barrows und Roeder (1965), dass eine KR bei adulten Ratten zu einer verringerten mittleren Lebensdauer führte. Allerdings könnte dieses widersprüchliche Ergebnis in der Durchführung der Studie begründet liegen. Die KR-Gruppe dieser Studie erhielt nur 50 % der Nahrung der AL gefütterten Kontrollgruppe sowie keine Ergänzung mit Vitaminen oder Mineralien. Es ist vorstellbar, dass die verringerte mittlere Lebensdauer der KR-Gruppe dieser Studie eine Folge von Mangelernährung ist.
Von den oben genannten Studien sprechen vor allem die Ergebnisse von Yu et al. (1985) gegen diese Hypothese. Würden die Wirkungen der KR über ein verzögertes Wachstum vermittelt werden, müsste einer KR in der Phase des schnellen Wachstums die größten Auswirkungen auf die Lebensdauer haben und im ausgewachsenen Zustand der Tiere keine oder kaum eine Wirkung zeigen.
4.2 Reduktion des Körperfettanteils
Berg und Simms (1960) stellten als erste die Hypothese auf, dass die lebensverlängernden Auswirkungen einer KR in der Reduktion des Körperfettanteils begründet liegen. Die Basis ihrer Hypothese ergab sich aber nicht direkt aus den Ergebnissen ihrer Studie, weil sie in dieser das Körperfett der Tiere nicht maßen. Sie zeigten in ihrer Studie lediglich, dass eine KR bei Ratten zu weniger Läsionen und Tumoren und einer höheren Überlebensrate im Vergleich zu einer AL-Fütterung führt. Sie stützten ihre Hypothese nur auf die Annahme, dass eine KR zu einem verringerten Körperfettanteil führen müsste und dass ein erhöhter Körperfettanteil beim Menschen mit negativen Folgen für die Gesundheit und einem verfrühten Ableben in Verbindung gebracht wird (Masoro 2005).
Dass eine KR zu einem geringeren Körperfett führt, konnte in vielen Studien an Nagetieren (Bertrand et al. 1980; Harrison et al. 1984), an Primaten (Colman et al. 1998; Colman et al. 1999) und auch am Menschen (Racette et al. 2006) gezeigt werden.
Bertrand et al. (1980) untersuchten in einer Studie den Körperfettgehalt in Ratten unter KR oder AL-Fütterung über die gesamte Lebensdauer. Sie konnten feststellen, dass der Körperfettgehalt bei den meisten Ratten beider Gruppen über die Lebensdauer ansteigt bis etwa 75 % der Lebensdauer erreicht sind und er dann wieder abnimmt. Die Ratten der KR-Gruppe hatten zu jeder Zeit einen geringeren Körperfettanteil und hatten eine signifikant verlängerte mittlere und maximale Lebensdauer im Vergleich zur Kontrollgruppe. Auf Basis einer Korrelationsanalyse scheint die Schlankheit der Ratten unter KR kein bedeutender Faktor hinsichtlich der verlängerten Lebensdauer zu sein. Sie fanden für die Kontrollgruppe keinen signifikanten Zusammenhang zwischen dem maximal beobachteten Körperfettanteil und der Lebensdauer, für die KR-Gruppe jedoch schon. Also hatten die Ratten unter KR mit dem höchsten Körperfettanteil die längste Lebensdauer.
In einer weiteren Studie, in der der Einfluss des Körperfetts auf die Auswirkungen der KR untersucht wurde, wurden Mäuse mit genetisch bedingtem Übergewicht (obese mouse; ob/ob) und normale Mäuse eines Inzuchtstammes C57BL/6J (B6) jeweils in zwei Gruppen, eine Kontrollgruppe mit AL-Fütterung und eine KR-Gruppe eingeteilt. Beide KR-Gruppen wurden um das gleiche Maß restringiert und die Menge an Futter wurde so gewählt, dass die ob/ob-Mäuse unter KR das gleiche Körpergewicht wie die AL gefütterten B6-Mäuse halten konnten. Diese Menge war etwa zwei Drittel der Menge, die die B6-Mäuse unter AL-Fütterung fraßen und weniger als die Hälfte der Menge, die die ob/ob-Mäuse unter AL-Fütterung fraßen (Tab. 4.2 1) (Harrison et al. 1984).
Tab. 4.2.1: Gewicht, Nahrungsmenge und Lebensdauer von B6-Mäusen und ob/ob-Mäusen mit genetisch bedingten Übergewicht (modifiziert nach Harrison et al. 1984).
|
Gruppe |
Nahrungsmenge
(g/Tag) |
Körpergewicht (g) | Körperfettanteil
(in % vom KG) |
Lebensdauer | |
| mittlere | maximale | ||||
| AL ob/ob | 4,2 | 59 ± 5 | 67 ± 5 | 526 ± 36 | 776-893 |
| AL B6 | 3,0 | 30 ± 1 | 22 ± 6 | 771 ± 28 | 954-976 |
| KR ob/ob | 3,0 | 28 ± 2 | 48 ± 1 | 823 ± 46 | 1209-1307 |
| KR B6 | 2,0 | 20 ± 2 | 13 ± 3 | 810 ± 48 | 1089-1287 |
Anmerkung: Alle Mäuse waren weiblich. Das Körpergewicht und der Körperfettanteil wurde für 6 – 12 Monate alte Tiere bestimmt (n = 4 – 8 pro Gruppe). Die untersuchten Tiere unterschieden sich nicht signifikant im Alter. Die Nahrungsmengen stellten Durchschnittswerte dar, die in einer Woche nach 4,5 Monaten und jeweils 8 Tieren/Gruppe ermittelt wurden. Die Ergebnisse sind dargestellt als Durchschnittswerte ± SEM. Lebensdauer ist angegeben in Tagen. Die maximale Lebensdauer ist angegeben als die Spanne der am längsten lebenden 10 % der Gruppe. Für die Lebensdauerdaten (n= 29 – 39 pro Gruppe)
Es konnte beobachtet werden, dass die ob/ob-Mäuse unter KR trotz ihres immer noch sehr hohen Körperfettanteils von fast 50 % eine deutliche verlängerte mittlere und maximale Lebensdauer aufwiesen (Tab. 4.2 1). Die Verlängerung der Lebensdauer der ob/ob-Mäuse unter KR fiel höher aus als bei den B6 Mäusen unter KR, was wahrscheinlich mit dem höheren Grad der Restriktion der ob/ob-Mäuse zusammenhängt (Harrison et al. 1984).
Die Ergebnisse der Studien sprechen stark gegen die Reduktion des Körperfettanteils als ursächlichen Mechanismus für die Wirkungen der KR. Das Ergebnis der Studie von Bertrand et al. (1980), das eine positive Korrelation in der KR-Gruppe zwischen dem maximalen beobachteten Körperfett und der Lebensdauer zeigt, muss jedoch in seiner Aussagekraft hinterfragt werden. Die Daten, die zu dieser Korrelation führten, waren lediglich aus 16 Ratten der KR-Gruppe gewonnen worden. Dennoch führten diese beiden Studien dazu, dass unter den meisten Forschern die Hypothese des verringerten Körperfettanteils als widerlegt galt (Barzilai und Gupta 1999).
Barzilai und Gupta (1999) veröffentlichten ein Paper mit dem Namen Revisiting the Role of Fat Mass in the Life Extension Induced by Caloric Restriction, in dem sie die neuen Erkenntnisse über das Fettgewebe als endokrines Organ mit den Wirkungen der KR in Verbindung brachten. Sie nahmen an, dass vor allem das viszerale Fettgewebe (VF) und die im Fettgewebe gebildeten und sezernierten Peptide wie der Tumor-Nekrose-Faktor α (TNF-α) und Leptin eine übergeordnete Rolle für die Wirkung der KR einnehmen.
Muzumdar et al. (2008) untersuchten in einer Studie die Auswirkungen einer Entnahme des VF auf die Lebensdauer im Vergleich zu einer KR. Dazu bildeten sie drei Gruppen: (1) eine Kontrollgruppe, die AL gefüttert wurde; (2) eine KR-Gruppe mit einer KR um 40 %; und (3) eine Gruppe mit Ratten, die auch AL gefüttert wurden, aber denen im Lebensalter von 5 Monaten ein Teil des VF entnommen wurde (VF-Gruppe). Sie konnten zeigen, dass die KR-Gruppe im Mittel das geringste Gewicht, den geringsten Körperfettanteil und die längste mittlere und maximale Lebensdauer von allen drei Gruppen aufwies. Die VF-Gruppe und die Kontrollgruppe hatten über die gesamte Lebensdauer im Mittel keine signifikanten Unterschiede im Körpergewicht, jedoch hatte die VF-Gruppe signifikant weniger viszerales Fettgewebe als die Kontrollgruppe. Die VF-Gruppe hatte eine verlängerte mittlere und maximale Lebensdauer im Vergleich zur Kontrollgruppe. Die Autoren stellten einen Vergleich hinsichtlich der Verlängerung der mittleren Lebensdauer der KR- und der VF-Gruppe auf und konnten zeigen, dass die KR-Gruppe eine um 47 Wochen längere und die VF-Gruppe eine um 9,5 Wochen längere Lebensdauer als die Kontrollgruppe zeigten. Daraus schlussfolgerten sie, dass etwa 20 % der Lebensdauer verlängernden Wirkung der KR auf die Veränderungen im viszeralen Fettgewebe zurück zu führen sei.
Zusammenfassend lässt sich sagen, dass eine Reduktion des Körperfettanteils als ursächlicher Faktor für die Wirkungen der KR als alleiniger Mechanismus eher ausgeschlossen werden kann. Die von Berg und Simms (1960) auf einfache Annahmen basierende Hypothese konnte durch die Erkenntnisse von Bertrand et al. (1980) und Harrison et al. (1984) vorerst widerlegt werden, auch wenn die Studien Schwächen aufwiesen. Die Hypothese der Reduktion des Körperfettanteils erweitert um die Annahme, dass das Fettgewebe durch seine Rolle als endokrines Organ und den komplexen Wechselwirkungen der sezernierten Hormone, die teilweise die Wirkung der KR erklären könnten, erscheint plausibler und wird auch durch den Versuch von Muzumdar et al. (2008) bestärkt. Eine endgültige Aussage zur Rolle des Fettgewebes für die Wirkungen der KR kann jedoch nicht gemacht werden. Dazu bedarf es weiterer Forschung.
4.3 Reduktion der Stoffwechselrate
Aufbauend auf der Rate of Living Theory (siehe Kapitel 2.1) stellte Saccher (1977) die Hypothese auf, dass die lebensverlängernde Wirkung der KR auf eine verringerte Stoffwechselrate pro Masseneinheit unter einer KR zurück zu führen sei. Seine Hypothese basierte auf Berechnungen, die er mit Daten einer Studie von Ross (1972) durchführte. Er schloss aus seinen Berechnungen, dass die Ratten unter KR eine geringere Menge an Nahrung pro Masseneinheit aufnahmen, aber die Kalorienaufnahme pro Masseneinheit bezogen auf die gesamte Lebensdauer sich zwischen diesen und den AL gefütterten Ratten nicht unterschieden (Masoro et al. 1982).
Die einzigen Daten, die für die Hypothese sprechen, sind Daten aus Kurzzeitstudien, die eine verringerte Stoffwechselrate durch eine KR belegen. Bei Rhesusaffen konnte in einer Kurzzeitstudie, die eine monatliche Abnahme der Kalorienhöhe um 10 % der Ausgangsmenge (AL-Fütterung) über 3 Monate untersuchte, eine signifikant geringere Stoffwechselrate pro kg fettfreier Körpermasse festgestellt werden (Lane et al. 1996). Belegt werden konnte auch, dass eine kurzfristige verringerte Kalorienaufnahme zu einer verringerten Stoffwechselrate beim Menschen führt (Lammert und Hansen 1982; Heyman et al. 1992; Velthuis-te Wierik et al. 1995).
Die Studienlage, die gegen die Hypothese der verringerten Stoffwechselrate als zugrunde liegenden Mechanismus für die lebensverlängernde Wirkung der KR spricht, erscheint eindeutig:
Masoro et al. (1982) konnten in einer Studie zeigen, dass eine KR um 40 % bei Ratten zu keiner geringeren Kalorienaufnahme pro Masseneinheit im Vergleich zu der AL gefütterten Kontrollgruppe führt. Die Kalorienaufnahme pro Masseneinheit bezogen auf die gesamte Lebensdauer war für die Ratten unter KR sogar höher als die der AL gefütterten Ratten.
McCarter et al. (1985) untersuchten in einer weiteren Studie die Stoffwechselrate von Ratten unter KR im Vergleich zu AL gefütterten Ratten. Die Stoffwechselrate wurde für 23,75 Stunden anhand des Sauerstoffverbrauchs und der Kohlenstoffdioxidproduktion für jedes Tier einzeln bestimmt. Sie konnten feststellen, dass die Stoffwechselrate pro kg Körpergewicht der Tiere unter KR höher als die der AL gefütterten Tiere war. Bezüglich der Stoffwechselrate pro kg fettfreier Körpermasse konnten sie keinen signifikanten Unterschied zwischen den beiden Gruppen feststellen.
Auch eine Studie von McCarter und Palmer (1992) brachte weitere Evidenz gegen die Hypothese der verringerten Stoffwechselrate. Sie untersuchten die tägliche Stoffwechselrate von Ratten unter KR und von AL gefütterten Ratten über die gesamte Lebensdauer. Die Stoffwechselrate wurde indirekt durch Messung des O₂- und CO₂-Gehaltes der Luft, die in den Käfig hinein und hinaus strömt, gemessen. Sie konnten für beide Gruppen gleiche Veränderungen der täglichen Stoffwechselrate über die Lebensdauer feststellen, mit einem Anstieg der Stoffwechselrate zwischen dem 2. und 6. Lebensmonat, einer konstanten Rate zwischen dem 6. und 18. Lebensmonat und einem leichten Anstieg ab dem 18. Lebensmonat. Die Stoffwechselrate pro kg fettfreier Körpermasse unterschied sich über die gesamte Lebensdauer nicht zwischen den beiden Gruppen, ausgenommen einer kurzen Phase nach der Einführung der KR, in der die Ratten unter KR eine niedrigere Stoffwechselrate als die AL gefütterten Ratten hatten.
Auch bei D. melanogaster konnte keine Veränderungen des Grundumsatzes pro Körpermasse, gemessen durch den Sauerstoffverbrauch oder die Wärmeproduktion, unter KR im Vergleich zu nicht restringierten Fliegen beobachtet werden (Hulbert et al. 2004).
In einer Studie an Rhesusaffen, in der die Stoffwechselrate nach 11 Jahren KR um 30 % untersucht wurde, konnte kein signifikanter Unterschied der Stoffwechselrate pro kg fettfreier Körpermasse im Vergleich zu der AL gefütterten Kontrollgruppe gefunden werden (Blanc et al. 2003).
Auf kurze Sicht scheint eine KR zu einer verringerten Stoffwechselrate pro kg fettfreier Masse im Vergleich zu einer AL-Fütterung zuführen. Eine langfristige oder lebenslange KR führt jedoch zu keiner verringerten Stoffwechselrate pro kg fettfreier Körpermasse (McCarter et al. 1985; Blanc et al. 2003). Die höhere Kalorienaufnahme pro Masseneinheit bezogen auf die Lebensdauer unter KR spricht auch gegen die Hypothese. Eine verringerte Stoffwechselrate scheint nicht nötig für die Auswirkungen der KR auf die Lebensdauer zu sein, und somit kann sie als alleiniger zugrunde liegender Mechanismus der KR eher ausgeschlossen werden.
4.4 Verringerung des oxidativen Stresses
Wie in Kapitel 2.2 angesprochen werden oxidative Schäden an der DNA, Proteinen, Lipiden und vor allem an den Mitochondrien als ein wesentlicher Faktor für das Altern angesehen. Der oxidativen Stress-Hypothese des Alterns nach, sind die altersbedingten Funktionsverluste auf die progressiven und irreversiblen Anhäufungen von oxidativen Schäden an Molekülen zurückzuführen. Die Anhäufung von oxidativen Schäden wird wesentlich durch drei Faktoren bestimmt: (1) eine erhöhte Produktion von freien Radikalen und anderen reaktiven Molekülen (vor allem reaktive Sauerstoffspezies (ROS)); (2) verringerte antioxidative Abwehrmechanismen; und (3) verringerte Effizienz in der Reparatur und im Entfernen von geschädigten Molekülen (Sohal und Weindruch 1996).
Es wurde postuliert, dass die KR ihre Wirkungen durch eine Verringerung des oxidativen Stresses entfaltet, in dem sie entweder die Entstehung von freien Radikalen verringert oder die Abwehr- und/oder Reparaturmechanismen hochreguliert (Sohal und Weindruch 1996; Yu 1996). In vielen Studien an Nagetieren konnten unter KR verringerte Marker für oxidativen Schäden in verschiedenen Geweben festgestellt werden (Sohal und Weindruch 1996; Merry 2004). Die verringerten Schäden lassen sich größtenteils auf eine verringerte Produktion von ROS in den Mitochondrien zurückführen. Dabei wurden die Daten, die zu diesem Ergebnis führten, hauptsächlich durch die Analyse von isolierten Mitochondrien und unter nicht physiologischen Bedingungen erhoben (Merry 2004). Auch bei Rhesusaffen unter KR und in Kurzzeitstudien am Menschen (CALERIE Phase 1) konnten verringerte Marker für oxidative Schäden gefunden werden (Zainal et al. 2000; Meydani et al. 2011). Houthoofd et al. (2003) konnten in C. elegans unter KR und auch in langlebigen Mutanten des Fadenwurms eine erhöhte Aktivität der beiden antioxidativen Enzyme Superoxid Dismutase (SOD) und Katalase beobachten.
Eine Möglichkeit, um zu überprüfen ob oxidative Schäden oder vermehrter oxidativer Stress das Altern und die Lebensdauer beeinflussen, ist die Manipulation von Genen, die für die Expression von antioxidativen Systemen wichtig sind (Pérez et al. 2009). In D. melanogaster und auch in Mäusen konnten durch Mutationen in Genen, die zu einer geringeren Aktivität der SOD führen, ein erhöhter oxidativer Stress und eine verringerte Lebensdauer beobachtet werden (Phillips et al. 1989; Elchuri et al. 2005). Kontroverse Ergebnisse lieferten van Remmen et al. (2003): Sie untersuchten Mäuse, die heterozygot für das sod2 Gen (sod2 +/- Mäuse) waren. Die sod2 +/- Mäuse zeigten eine lebenslange verringerte Aktivität der Mangan abhängigen Superoxid Dismutase (MnSOD) im Vergleich zu Wildtyp-Mäusen. Die Autoren konnten zeigen, dass verschiedene Gewebe der sod2 +/- Mäuse über die gesamte Lebensdauer mehr oxidative Schäden aufwiesen als Gewebe der Wildtyp-Mäuse. Die erhöhten oxidativen Schäden an der DNA der sod2 +/- Mäuse standen im Zusammenhang mit einem erhöhten Auftreten von Krebs. Die Lebensdauer der sod2 +/- Mäuse unterschied sich jedoch nicht von der der Wildtyp-Mäusen, und es konnten auch keine sonstigen Anzeichen eines früheren Alterns bei den sod2 +/- Mäusen beobachtet werden. Zusätzlich konnten Pérez et al. (2009) zeigen, dass transgene Mäuse mit einer Überexpression von einem antioxidativen System (Katalase oder MnSOD oder der Kupfer-Zink-Superoxid-Dismutase) oder in Kombination keine Verlängerung der Lebensdauer im Vergleich zu Wildtyp-Mäusen aufwiesen. Schriner et al. (2005) konnten wiederum zeigen, dass bei transgenen Mäusen eine Überexpression der Katalase entweder in den Zellkernen, den Peroxisomen oder den Mitochondrien zu einer verlängerten mittleren Lebensdauer führte. Eine signifikant verlängerte maximale Lebensdauer konnten sie aber nur bei einer Überexpression der Katalase in den Mitochondrien beobachten.
Zusammenfassend lässt sich sagen, dass die KR oxidative Schäden an verschiedenen Geweben verringert und dies wahrscheinlich auch durch eine vermehrte Aktivität von antioxidativen Enzymsystemen geschieht. Die Frage, ob die verringerten oxidativen Schäden der zugrunde liegende Mechanismus der Lebensdauer verlängerten Effekte der KR sind, bleibt ungeklärt. Die kontroversen Ergebnisse der genannten Studien, die die erhöhten oder verringerten oxidativen Schäden durch Über- oder Unterexpression von verschiedenen antioxidativen Systemen auf die Lebensdauer untersuchten, zeigten keine einheitliche Wirkungen auf die Lebensdauer. Auch wenn die verringerten oxidativen Schäden durch eine KR keine Auswirkungen auf die Lebensdauer haben sollten, liefert die Studie von van Remmen et al. (2003) Hinweise darauf, dass sich verringerte oxidative Schäden günstig auf die Entstehung von Krebs auswirken könnten.
4.5 Veränderungen der Wachstumshormon-IGF-1-Achse
Das Wachstumshormon (growth hormone; GH) ist ein Proteinhormon, das im Hypophysenvorderlappen gebildet wird und viele direkte und indirekte Effekte auf Zellen und Gewebe hat. GH hat z. B. Einfluss auf das Knochen- und Gewebewachstum und nimmt Einfluss auf den Kohlenhydrat-, Fett- und Proteinstoffwechsel. Direkte biologische Aktivitäten des GH sind die Bindung an Rezeptoren (growth hormone receptor; GHR), die Internalisierung des Hormon/Rezeptor-Komplexes und die Aktivierung von Proteinen, die an der Signaltransduktion beteiligt sind (Coschigano et al. 2000). In frühen Lebensphasen des Menschen sind die GH-Spiegel im zirkulierenden Blut hoch. Sie sind mit verantwortlich für das schnelle Körperwachstum und nehmen nach dem Erreichen der physischen und geschlechtlichen Reife ab. Somit sind die Plasmaspiegel des GH in älteren Personen viel geringer als in jungen Erwachsenen. Der altersbedingte Abfall der GH-Spiegel kommt primär durch eine reduzierte hypothalamische Sekretion des GH-releasing hormone (GHRH) zustande. Daraus resultiert eine Abnahme der GH Biosynthese im Hypophysenvorderlappens. Dies hat zur Folge, dass auch der Spiegel an IGF-1, der einen Schlüsselmediator für die Wirkung des GH darstellt, abnimmt. Ein altersbedingter Abfall an GH kann auch bei vielen anderen Säugetieren beobachtet werden (Bartke 2008). Einige altersbedingte Veränderungen wie die Abnahme an Muskelmasse, ein erhöhter Körperfettanteil und eine verringerte Libido werden auf die geringen GH- und IGF-1-Spiegel im Alter zurückgeführt. Aus diesem Grund findet eine Substitution mit GH vielfach als Anti-Aging-Mittel Verwendung. Jedoch wird diese Verwendung stark kritisiert, da keine Erkenntnisse aus Langzeitstudien vorliegen, die eine sichere Verwendung belegen (Bartke et al. 2000).
Anders als erwartet, wird die Verbindung zwischen der GH-IGF-1-Achse und der KR nicht wie auf Effekte von erhöhten GH- und IGF-1 Spiegeln zurückgeführt, sondern auf verringerte. Eine Reihe von Mutationen in Genen von Mäusen, die die Aktivität der GH-IGF-1-Achse verringern oder die GHR beeinflussen, führen zu einer verlängerten Lebensdauer dieser (Brown-Borg et al. 1996; Coschigano et al. 2000; Flurkey et al. 2001). Coschigano et al. (2000) untersuchten Mäuse mit einer Deletion des GHR/BP-Gens, die zu einem GHR Mangel führt und somit zu weniger Aktivität der GH-IGF-1-Achse. Die Autoren verglichen drei Gruppen miteinander: (1) eine Gruppe mit transgenen Mäusen, die keine Deletion des Gens hatte (+/+); (2) eine Gruppe mit heterozygoten Mäusen (+/-); und (3) eine Gruppe mit homozygoten Trägern dieser Deletion (-/-). Die -/- Mäuse hatten eine geringere Wachstumsrate als die Mäuse der anderen beiden Gruppen, und sie hatten weniger als 10 % IGF-1 im Plasma im Vergleich zu den +/+ Mäusen. Die -/- Mäuse hatten eine signifikant verlängerte Lebensdauer im Vergleich zu den anderen beiden Gruppen (Tab. 4.5. 1).
Tab. 4.5.1: Die mittlere Lebensdauer von Mäusen mit einer Deletion im GHR/BP-Gen im Vergleich zu transgenen und heterozygoten Mäusen (modifiziert nach Coschigano et al. 2000)
| Geschlecht | Genotyp | Anzahl | Lebensdauer (Tagen)ᵃ |
| Männlich | +/+ | 7 | 629 ± 72 |
| +/- | 8 | 668 ± 51 | |
| -/- | 7 | 975 ± 106ᵇ | |
| Weiblich | +/+ | 13 | 749 ± 41 |
| +/- | 19 | 701 ± 36 | |
| -/- | 11 | 1031 ± 41ᶜ |
Anmerkung: ᵃ mittlere Lebensdauer ± SE. ᵇ p< 0,01 im Vergleich zu +/+. ᶜ p< 0,0002 im Vergleich zu +/+
In weiteren Untersuchungen an Mausmodellen mit anderen Genmutationen, die die GH-IGF-1-Achse oder die GHR in ihrer Aktivität mindern, konnten ähnliche Auswirkungen auf die mittlere und auch maximale Lebensdauer gefunden werden (Brown-Borg et al. 1996; Flurkey et al. 2001).
Sonntag et al. (1992) konnten zeigen, dass eine KR bei Mäusen zu einem etwa um 30 % verringerten IGF-1-Spiegel im Vergleich zu AL gefütterten Mäusen führt und die normalerweise im Alter beobachtbare Abnahme des IGF-1 Spiegels ausbleibt. Dieses Ergebnis liefert einen Hinweis für die Annahme, dass die Effekte der KR auf eine verringerte Aktivität der GH-IGF-1-Achse zurückzuführen sind.
Eine Studie von Bonkowski et al. (2006) liefert Evidenz für diese Annahme. Sie untersuchten Mäuse, bei denen die Expression eines Gens, das für die Ausbildung des GHR und des GH bindenden Proteins (GH binding protein; GHBP) wichtig ist, ausgeschaltet wurde (knock-out; KO). Diese GHRKO-Mäuse wurden entweder AL gefüttert oder unter 30 % KR gesetzt und zusätzlich wurden auch Kontroll-Mäuse, ohne Gen-KO, in eine KR-Gruppe und eine AL-Gruppe eingeteilt. Sie konnten eine verlängerte mittlere und maximale Lebensdauer der AL-GHRKO-Mäuse, der Kontroll-Mäuse unter KR und der KR-GHRKO-Mäuse im Vergleich zu den AL gefütterten Kontroll-Mäusen beobachten. Ein Vergleich der AL-GHRKO- und KR-GHRKO-Mäuse zeigte jedoch, dass die KR zu keiner weiteren Verlängerung der mittleren oder maximalen Lebensdauer führte. Zusätzlich konnte eine verbesserte Insulinsensitivität der AL-GHRKO-Mäuse festgestellt werden. Jedoch konnte diese durch eine KR nicht weiter verbessert werden. Eine weitere Studie von Hursting et al. (1993) untersuchte die Auswirkungen einer KR bei Ratten, denen Zellen von an Leukämie erkrankten Ratten transplantiert wurden. Die um 25 % restringierten Ratten hatten etwas weniger als 50 % der Menge an GH und IGF-1 im Serum und eine geringere Ausbreitung an Neoplasien als die AL gefütterte Kontrollgruppe. Die Autoren führten die tumorsuppressive Wirkung der KR auf die verringerten GH-und IGF-Spiegel unter KR zurück. Weiteren Zuspruch für die Rolle der GH-IGF-1-Achse in der Wirkung der KR kommt aus Studien am Wurm C. elegans und der Taufliege D. melanogaster. Für die beiden Modellorganismen gibt es viele Hinweise, dass der Insulin/IGF-1-Singnalweg für die Wirkungen der KR eine Rolle spielt (nähere Erläuterung in Kapitel 4.6). Da in den beiden Spezies aber keine getrennten Rezeptoren für Insulin und IGF-1 vorliegen, kann hier nicht direkt zwischen den durch Insulin oder IGF-1 vermittelten Effekten unterschieden werden (Masoro 2005). Ausgehend von den Ergebnissen an den Mausmodellen, mit den durch Genmutation erzeugten Veränderungen der GH-IGF-1-Achse und den beobachteten lebensverlängerten Wirkungen, scheinen GH und IGF-1 eine Rolle in den Lebensdauer bestimmenden Mechanismen zu spielen. Eine KR führt zwar zu verringerten GH- und IGF-1-Spiegeln, damit ist aber noch nicht bewiesen, dass diese auch für alle Wirkungen einer KR verantwortlich sind. Die Studie von Bonkowski et al. (2006), in der keine weitere Verlängerung der Lebensdauer oder eine weitere Verbesserung der Insulinsensitivität durch eine KR bei GHRKO-Mäusen gezeigt werden konnte, gibt Hinweise darauf, dass die KR und eine verringerte GH-IGF-1-Achse die Lebensdauer über die gleichen oder überlappende Mechanismen beeinflussen. Zusätzlich lässt die Studie von Hursting et al. (1993) auch Schlüsse dahingehend zu, dass die tumorsuppressive Wirkung, die bei einer KR zu beobachten ist, auf das verringerte Wirken von GH und IGF-1 zurückzuführen ist. Es scheint daher möglich, dass die GH-IGF-1-Achse einen Teil der Wirkungen der KR erklären kann. Es bedarf aber auch hier weiterer Forschung.
4.6 Veränderungen des Glukose-Insulin-Systems
Sowohl bei Nagetieren als auch bei Rhesusaffen unter KR fanden sich verringerten Glukose- und Insulinspiegel im Plasma (Masoro et al. 1992; Kemnitz et al. 1994). Der Hinweis, dass ein verringerter Insulinspiegel eine grundlegende Rolle in der Auswirkung der KR auf die Lebensdauer einnehmen könnte, kam aus Studien mit den Modellorganismen C. elegans und D. melanogaster. Hier hat sich ein Signalweg als wahrscheinlicher Regulator der Lebensdauer herausgestellt, der sogenannte Insulin/IGF-1 Signalweg (IIS). Der IIS hat sowohl zelluläre als auch systemische Komponenten und verbindet Prozesse, die durch eine Nahrungsaufnahme ausgelöst werden wie Wachstum, Stoffwechsel und Reproduktion mit dem Energiestatus des Organismus (Gems und Partridge 2013).
Mutationen in zwei für den IIS wichtigen Genen (daf-2 oder age-1 Gen), konnte die Lebensdauer bei C. elegans um mehr als das doppelte verlängern (Friedman und Johnson 1988; Kenyon et al. 1993). Daf-2 ist ein Gen, das für den einzigen Insulin/IGF-1 Rezeptor in C. elegans kodiert, und age-1 ist wichtig für eine katalytische Untereinheit der im IIS downstream wirkenden Phosphatidylinositol-3-kinase (PI3K). Für C. elegans haben sich weitere Komponenten des IIS als wichtig für die Regulation der Lebensdauer herausgestellt, darunter der eben genannte Insulin/IGF-1 Rezeptor DAF-2, AGE-1 ein Homolog zur PI3K, einige orthologe Proteine zu der AKT-Kinase (akt-1, akt-2 und sgk-1) und der Forkhead-Transkriptionsfaktor DAF-16 (Kaeberlein et al. 2006; Kaletsky und Murphy 2010). Normalerweise funktioniert der IIS, indem das Substrat an den Rezeptor DAF-2 bindet. Dieser aktiviert dann die PI3K, welche den Transkriptionsfaktor DAF-16 phosphoryliert und ihn damit inaktiviert, sodass er nicht in den Zellkern eindringt und nicht seine Aktivität als Transkriptionsfaktor wahrnehmen kann. Wird der IIS weniger stark aktiviert oder durch Mutationen von Genen wie daf-2 oder age-1 gehemmt, wird DAF-16 am Ende nicht phosphoryliert und dadurch aktiviert und dringt somit in den Zellekern ein und setzt das transkriptionelle Programm in Gang, welches für die Verlängerung der Lebensdauer wichtig ist. Vermutlich handelt es sich beim IIS um einen evolutionär konservierten Signalweg, der auch bei vielen anderen Spezies wie z. B. Fliegen und Mäusen vorkommt. In D. melanogaster findet sich auch nur ein Insulin/IGF-1 Rezeptor (dInR), der in der gleichen Weise zu einer Verlängerung der Lebensdauer wie bei C. elegans führt, wenn eine Mutation des Transkriptionsfaktor dFOXO, ein Homolog zu DAF-16, vorliegt. Säugetiere kodieren mehrere DAF-2 Homologe wie den IGF-1 Rezeptor, den Insulinrezeptor (IR) –A und IR-B, was zu einer größeren Komplexität führt (Kaletsky und Murphy 2010). Der IGF-1 Signalweg scheint auch für die Lebensdauer von Säugetieren wie der Maus eine Rolle zu spielen (siehe Kapitel 4.5).
Ob der IIS auch an der lebensverlängernden Wirkung der KR beteiligt ist, lässt sich überprüfen indem man Modellorganismen mit einer Mutation in einem der für den IIS wichtigen Gene unter KR setzt. Lakowski und Hekimi (1998) konnten zeigen, dass gleichzeitige Mutationen sowohl im eat-2 Gen, die zu einer verringerten Nahrungsaufnahme führt, als auch im daf-2 Gen zu einer längeren Lebensdauer des C. elegans führt als durch eine der Mutationen alleine. Aus diesen Ergebnissen folgerten sie, dass eine KR durch eine eat-2 Mutation in C. elegans die Lebensdauer durch einen anderen Mechanismus als in daf-2 Mutanten verlängert und damit keine Beteiligung des IIS an der Lebensdauer verlängernden Wirkung einer KR in eat-2 Mutanten vorliegt. Auch Houthoofd et al. (2003) untersuchten die Wirkung von zwei unterschiedlichen Methoden der KR bei C. elegans mit Mutationen, die den IIS beeinflussen, und kamen zu ähnlichen Schlüssen. Sie konnten sowohl bei einer KR durch Verdünnung des bakteriellen Nährmediums als auch bei einer KR durch Verdünnung eines keimfreien Nährmediums mit definierten Nährstoffen eine Verlängerung der Lebensdauer von daf-16 Mutanten, die normalerweise eine Verlängerung der Lebensdauer durch eine verringerte Aktivität des IIS unterdrücken, beobachten. Weiterhin konnten sie auch bei daf-2 Mutanten noch eine zusätzliche Verlängerung der Lebensdauer durch beide Methoden der KR feststellen. Bei D. melanogaster hingegen konnte die Lebensdauer verlängernde Wirkung der KR auf den IIS zurückgeführt werden. An langlebigen D. melanogaster Mutanten mit einer Mutation des Insulinrezeptor-Substratproteins chico konnten unter KR die gleichen Auswirkungen auf die Lebensdauer beobachtet werden wie bei normalen D. melanogaster unter KR. Jedoch konnte die maximale Lebensdauer der Mutanten bei einer im Vergleich zu den Kontroll-Fliegen höheren Konzentration der Nahrung beobachtet werden. Daraus schlossen die Autoren, dass die unter KR beobachtete Verlängerung der Lebensdauer abhängig vom IIS ist(Clancy et al. 2002).
Der IIS und seine Funktion als Vermittler der durch die Nahrungsaufnahme ausgelösten Signale lässt die Annahme zu, dass er für die Wirkungen der KR als der oder ein zugrunde liegender Mechanismus agiert.
4.7 Hormesis-Hypothese
Der Begriff Hormesis wird im Gebiet der Toxikologie verwendet und beschreibt eine zweiphasige dosisabhängige Reaktion auf eine toxische Substanz. So führt dieselbe Substanz in einer geringen Dosis zu einer vorteilhaften und in einer hohen Dosis zu einer hemmenden oder schädlichen Wirkung. Die Reaktion einer Zelle oder eines Organismus auf eine geringe Dosis einer toxischen Substanz ist eine Art Anpassungsreaktion, die durch eine Störung der Homöostase ausgelöst wird (Mattson 2008). Allgemein kann Hormesis als der qualitative Unterschied in der Reaktion eines Organismus, der einem chemischen oder physikalischen Agens entweder in einer hohen oder einer niedrigen Konzentration ausgesetzt ist, definiert werden (Calabrese und Baldwin 1998).
Die Hormesis-Hypothese wurde 1998 gleichzeitig von Masoro (1998) und Turturro et al. (1998) aufgestellt. Sie vermuteten, dass die lebensverlängernden Auswirkungen einer KR durch die Hormesis erklärt werden könnten. Demnach führt eine sehr starke Einschränkung der Kalorienaufnahme zu schweren Schäden bis hin zum Tod, wohingegen eine moderate Reduktion der Kalorienzufuhr, wie es bei der KR der Fall ist, zu einer verlängerten Lebensdauer und verzögertem Altern führt.
Nagetiere unter KR zeigen die für eine Hormesis charakteristische Eigenschaft einer erhöhten Resistenz gegen andere schädigende Einflüsse (Masoro 2007). Heydari et al. (1993) konnten beobachten, dass mehr Ratten unter KR (75 %) eine mehrstündige Temperaturerhöhung über 33° C überlebten als AL gefütterte Ratten (16 %) gleichen Alters. Weiterhin konnten Keenan et al. (1997) beobachten, dass Ratten unter einer moderaten KR 2 – 4 mal höhere Dosen von verschiedenen toxischen Substanzen aufnehmen konnten als AL gefütterte Ratten bis erste messbare Effekte auftraten.
Rattan (2001) verfasste eine angepasste Definition der Hormesis bezogen auf die lebensverlängernden Auswirkungen. Er beschreibt Hormesis als die vorteilhaften Auswirkungen durch zelluläre Reaktionen auf andauernden milden Stress. Dieser führt dazu, dass Abwehr-, Instandhaltungs- und Reparaturprozesse stimuliert werden(Rattan 2004).
Für die Hormesis-Hypothese der KR sprechen einige Studien, die zeigten, dass andere milde Stressoren zu einer Verlängerung der Lebensdauer führen. So haben sich andere milde Stressoren wie Hitze, Strahlung oder eine erhöhte Gravitation als wirksam erwiesen, die Lebensdauer von verschiedenen Organismen – darunter S. cerevisiae, C. elegans, D. melanogaster – zu verlängern (Masoro 2007). Somit scheint die Hormesis durchaus als Mechanismus für die lebensverlängernde Wirkung der KR in Frage zu kommen.
Nach Masoro (1998) ist der leicht erhöhte Plasmaspiegel an Glukokortikosteron in Ratten (das wichtigste Glukokortikoid bei Ratten) unter KR ein Anzeichen dafür, dass eine KR zu einem milden anhaltenden Stress führt.
Die molekularen Mechanismen und Signalwege, die bei einer KR zu gesteigerten Abwehr-, Instandhaltungs- und Reparaturprozessen und somit zu einer erhöhten Stressresistenz führen, sind noch nicht vollständig aufgedeckt. Die Sirtuine, die zu der Klasse 3 der Histon / Protein-Deacetylasen gehören, scheinen an der Regulation von Abwehr- und Reparaturprozessen durch die KR beteiligt zu sein (Masoro 2007). Das erste Sirtuin, welches mit der Lebensdauer verlängernden Wirkung der KR in Verbindung gebracht wurde, war der silent information regulator 2 (SIR2) in S. cerevisiae (Lin et al. 2000). Die enzymatische Aktivität der meisten Sirtuine ist abhängig von Nicotinamid-adenin-dinucleotid (NAD) und somit abhängig vom Energiestatus des Organismus. Diese Sirtuine konnten in vielen Organismen gefunden werden. Es finden sich fünf Homologe in Hefen (SIR2 und HST1 – 4), SIR-2.1 in C. elegans, dSIR2 in D. melanogaster und sieben Sirtuine in Säugetieren (SIRT1 – 7) (Frye 2000). Das SIRT1 in Säugetieren deacetyliert eine Vielzahl von Substraten (darunter Transkriptionsfaktoren wie p53, NFkB und forkhead Proteine), die die Stressresistenz der Zellen beeinflussen und könnte somit für die erhöhte Stressresistenz, die bei Säugetieren unter KR beobachtet wird, verantwortlich sein (Haigis und Guarente 2006). Ein weiterer molekularer Mechanismus, der für die hormetischen Effekte verantwortlich sein könnte, ist die Aktivierung von Genen, die für eine Stressantwort wichtig sind (Masoro 2007). Gene, die für die Expression von Hitzeschockproteinen (HSP) zuständig sind, werden durch den Transkriptionsfaktor HSF-1 (Hitzeschock-Faktor-1) aktiviert. Dieser Transkriptionsfaktor liegt bei Würmern, Fliegen und in Säugetierzellen in einer inaktiven Form vor und wird durch erhöhten Stress aktiviert. Die Aktivierung von HSF-1 hat eine erhöhte Expression von HSPs wie die der Familie der HSP70 zur Folge. Dadurch wird die Stressresistenz der Zellen gegen eine Reihe von verschiedenen Stressoren erhöht (Raynes et al. 2012). Raynes et al. (2012) konnten zeigen, dass ein milder Hitzestress bei C. elegans zu einer vermehrten Aktivierung von Genen, die für HSP70 kodieren, führt und der Fadenwurm eine gesteigerte Toleranz gegen Hitzestress aufweist. Gleiches konnten sie auch ohne einen milden Hitzestress an C.elegans unter KR beobachten. Zusätzlich beobachteten sie, dass eine KR und ein milder Hitzestress beim Fadenwurm synergistisch wirken und zu einer noch höheren Aktivierung der hsp70-Gene und einer noch größeren Toleranz gegen Hitze führen. Weiterhin untersuchten sie C. elegans, mit einer homozygoten Deletion des sir2.1-Gens, die zur Synthese eines nicht funktionierenden Proteins führt. Sie konnten feststellen, dass die Aktivierung eines hsp70-Gens im Fadenwurm mit der Deletion unter KR ausblieb und eine KR in Kombination mit einem milden Hitzestresses zu keiner synergistischen Wirkung mehr führte. Somit konnten die Autoren eine Verbindung zwischen den Sirtuinen und der durch die HSPs vermittelten Stressresistenz aufzeigen.
Auch wenn die genauen molekularen Mechanismen, die zu der erhöhten Stressresistenz unter KR führen noch nicht vollständig aufgeklärt sind, scheinen komplexe Wechselwirkungen zwischen verschiedenen Genen, den synthetisierten Proteinen und der Aktivität von Transkriptionsfaktoren vorzuliegen. Die Studie von Raynes et al. (2012) zeigte, dass die durch verschiedene milde Stressoren ausgelöste erhöhte Stressresistenz teilweise auf den gleichen aktivierten Signalwegen beruhen könnte. Die Hormesis-Hypothese könnte somit einen Teil der Wirkungen einer KR, die mit einer erhöhten Stressresistenz in Verbindung stehen, erklären. Dennoch sind die so breit gefächerten Wirkungen der KR wahrscheinlich nicht allein durch diese Hypothese zu erklären. Masoro (2007) sieht seine Hypothese aber auch nicht als alleinigen Erklärungsansatz für alle Auswirkungen der KR. Vielmehr soll die Hormesis-Hypothese ein übergreifendes Konzept, in dem viele der anderen postulierten Mechanismen einen Teil der Wirkungen erklären können, darstellen.
5 Schlussfolgerung und Ausblick
Die KR ist die am besten erforschte Intervention, die sich als wirksam bewiesen hat, das Altern zu verlangsamen und die Lebensdauer zu verlängern. Die in Kapitel 3.2 und 3.3 angesprochenen Auswirkungen der KR, die sich teilweise in allen untersuchten Spezies beobachten lassen, zeigen das Potential der KR auf, möglicherweise auch die Gesundheit des Menschen zu verbessern.
Dennoch bleiben viele Fragen weiterhin ungeklärt, darunter die, nach den zugrunde liegenden Mechanismen der KR. Auch die Frage, ob eine KR die Lebensdauer des Menschen verlängern kann, wird sich vermutlich, da keine Langzeitstudien am Menschen durchführbar sind, vorerst nicht beantworten lassen. Weitere Studien, an den Mitgliedern der CR-Society könnten in Zukunft weitere interessante Erkenntnisse hinsichtlich der Langzeiteffekte einer KR bringen. Allerdings bleibt die Aussagekraft dieser Studien begrenzt, da es sich lediglich um nicht-kontrollierte Querschnittsstudien handelt (Meyer et al. 2006). Auch die Ergebnisse der Phase 2 der CALERIE-Studie sollen in naher Zukunft veröffentlicht werden und versprechen neue Erkenntnisse über die Wirkung der KR an normalgewichtigen Menschen (Stewart et al. 2013). Zukünftig sollten weitere kontrollierte und randomisierte Studien an gesunden und normalgewichtigen Probanden, wie das CALERIE-Projekt, durchgeführt werden. Ein Fokus könnte dabei besonders auf potentiellen negativen Auswirkungen der KR wie z. B. Einbußen in der kognitiven Leistungsfähigkeit und in der Lebensqualität der Probanden gelegt werden.
Die beiden Studien an Rhesusaffen lieferten bereits wichtige Erkenntnisse über die Auswirkung der KR bei einer langlebigen Spezies. Trotz der teilweise kontroversen Ergebnisse der beiden Studien lässt sich erkennen, dass eine langfristige KR als sicher einzustufen und mit gesundheitlichen Vorteilen verbunden ist. Die schon leichte Restriktion der Kontrolltiere der NIA-Studie und die aus natürlichen Bestandteilen zusammengesetzte Nahrung könnten die kontroversen Ergebnisse der beiden Studien erklären. Somit lassen die Ergebnisse der beiden Studien den Schluss zu, dass Zusammensetzung und Herkunft der Nahrung durchaus Einfluss auf die Gesundheit und die Lebensdauer der Tiere haben. Die Ergebnisse der NIA-Studie lassen eine Interpretation dahingehend zu, dass eine leichte Restriktion der Nahrungsaufnahme Vorteile mit sich bringt, sich eine stärkere Restriktion jedoch kaum zusätzlich positiv auswirkt. Dieser Aspekt ist sehr interessant, da eine zu strikte KR für den Menschen auf lange Sicht gesehen kaum praktikabel ist. Daraus lässt sich eine Implikation für den Menschen ableiten: Möglicherweise ist nur eine weniger strikte Ernährungsintervention nötig, um von den gesundheitlichen Vorteilen zu profitieren. Dieser Ansatz sollte weiter untersucht werden (Mattison et al. 2012; Colman et al. 2014).
Trotz der sehr ausgiebigen Erforschung der KR gibt es viele Kritikpunkte, die die Vergleichbarkeit der Ergebnisse innerhalb einer Spezies, und zwischen den verschiedenen Spezies deutlich erschweren. Die in vielen Studien oft nicht ausreichend beschriebenen Diätprotokolle, die teilweise sehr unterschiedlichen Verfahren der KR und eine nicht einheitliche Handhabung in der Ergänzung der Vitamine und Mineralstoffe können als Kritikpunkte genannt werden (Cerqueira und Kowaltowski 2010). Zusätzlich ist eine AL-Fütterung der Kontrollgruppe als kritisch zu werten. Ein aus der AL-Fütterung resultierendes Übergewicht könnte die Gesundheit und die Lebensdauer der Kontrolltiere negativ beeinflussen. Dadurch können auftretende Unterschiede zwischen den Gruppen nicht eindeutig auf die Auswirkungen einer KR zurückgeführt werden (Sohal und Forster 2014). Die oft nicht klare Verwendung der Begrifflichkeiten erschwert zusätzlich die Vergleichbarkeit der Studien. Oft wird der Begriff KR verwendet, auch wenn eine ausreichende Versorgung mit Vitaminen und Mineralien nicht gesichert ist. Umgekehrt wird der Begriff „Dietary Restriction“ in vielen Studien synonym zu KR verwendet. In anderen Studien hingegen werden beide Begriffe streng voneinander unterschieden (Masoro 2009; Cerqueira und Kowaltowski 2010).
Hinsichtlich der Mechanismen, die für die Wirkungen der KR verantwortlich sind, zeichnet sich ein zu den Prozessen des Alterns ähnlicher Wandel in den Sichtweisen ab: Standen bei den ersten hier beschriebenen Hypothesen einzelne physiologische Veränderungen, die unter KR zu beobachten sind, im Vordergrund wie z. B. die Reduktion des Körperfettanteils, geht man heute nicht mehr von einem alleinigen zugrunde liegenden Mechanismus, sondern von vielen sich gegenseitig beeinflussenden Prozessen aus (Masoro 2009). Die Forschung an Modellorganismen wie C. elegans und D. melanogaster und die Möglichkeiten der Genmodulation bringen immer neue Erkenntnisse, die dazu führen, dass zunehmend mehr der an den Wirkungen der KR beteiligten Gene, Proteine und Signalwege aufgedeckt werden. Die Hormesis-Hypothese war ein erster Versuch, den vielen komplexen Prozessen, die an der Wirkung der KR beteiligt sind, einen Rahmen zu geben. Dennoch geht man heute von einem noch komplexeren Geschehen aus (Masoro 2007, 2009). Die Erforschung der an der Wirkung der KR beteiligten Signalwege hat dazu geführt, dass nach Stoffen gesucht wird, die die Wirkung einer KR mimen können. In den letzten Jahren haben sich einige Stoffe wie z. B. Resveratrol und Rapamycin als potentielle KR-Mimetika herausgestellt. Diese werden weiter erforscht (Wood et al. 2004; Chen und Guarente 2007; Cabo et al. 2014; Si und Liu 2014).
Auch wenn eine KR sich als wirksam für den Menschen erweisen sollte, sind vermutlich nur wenige Menschen bereit langfristig mit einer so starken Einschränkung zu leben. Dennoch bringt die Erforschung der KR viele neue Erkenntnisse und vielleicht die Möglichkeit, mit einem Medikament, ganz ohne Einschränkungen, von den Vorteilen zu profitieren.
6 Zusammenfassung
Eine Kalorienrestriktion hat sich in vielen Spezies als wirksam erwiesen, dass Altern zu verlangsamen, die Lebensdauer zu verlängern und das Auftreten von altersbedingten Erkrankungen wie z. B. Herzkreislauferkrankungen und Krebs zu verzögern. Unter Altern kann die zeitunabhängige Abfolge von sich anhäufenden, progressiven, intrinsischen und schädlichen strukturellen und funktionellen Veränderungen, die sich normalerweise ab der Phase der Reproduktionsreife manifestieren und eventuell im Tod gipfeln, verstanden werden. Es gibt verschiedene Theorien die versuchen die Prozesse des Alterns zu erklären, aber heute sieht man das Altern als einen sehr komplexen und multifaktoriellen Prozess an. Eine Kalorienrestriktion kann durch verschiedene Verfahren durchgeführt werden und wird meistens an kurzlebigen Modellorganismen untersucht. Neben der Höhe der Restriktion, hat sich auch der Zeitpunkt ab dem mit der Kalorienrestriktion begonnen wird als wichtig für die Verlängerung der Lebensdauer erwiesen. Die Auswirkungen einer KR auf die Lebensdauer variieren auch bei verschiedenen Genotypen innerhalb einer Spezies. Seit über 20 Jahren werden zwei große Kalorienrestriktionsstudien an Rhesusaffen durchgeführt. In beiden Studien konnten positive Auswirkungen einer Kalorienrestriktion auf die Gesundheit der Tiere gefunden werden. Hinsichtlich der Verlängerung der Lebensdauer liefern die Studien jedoch kontroverse Ergebnisse. Kontrollierte Langzeitstudien am Menschen können, aufgrund der langen Lebensdauer des Menschen, gesundheitlicher Aspekte und der Zumutbarkeit einer so strengen Nahrungsintervention kaum realisiert werden. Eine Möglichkeit dennoch Einblicke der Wirkung der KR auf den Menschen zu erhalten, sind Beobachtungen an den Einwohnern Okinawas, die in der Vergangenheit wahrscheinlich unter KR ähnlichen Bedingungen gelebt haben, sowie an Menschen, die aus eigener Überzeugung eine KR praktizieren. Zusätzlich liegen Daten aus Kurzzeitstudien am Menschen vor, in denen die Auswirkungen einer KR untersucht wurden. In diesen konnten teilweise zu den Erkenntnissen aus Tierexperimenten ähnliche Auswirkungen einer Kalorienrestriktion gefunden werden. Die Frage, ob eine Kalorienrestriktion auch die Lebensdauer beim Menschen verlängern kann bleibt jedoch ungeklärt. Seit Beginn der Forschung im Gebiet der Kalorienrestriktion wurden viele Hypothesen zu den zugrunde liegenden Mechanismen der KR aufgestellt. Keine der vorgeschlagenen Hypothesen scheint die Auswirkungen einer KR alleine erklären zu können. Vielmehr scheinen viele Prozesse, die sich gegenseitig beeinflussen, an der Wirkung der KR beteiligt zu sein.
7 Literaturverzeichnis
[1] Arking R
Biology of Aging: Observations and Principles. Oxford University Press, New York, 3. ed., 2006
[2] Armbrecht HJ
The biology of aging. J Lab Clin Med 138:220–225, 2001
[3] Barrows CH, Roeder LM
The effect of reduced dietary intake on enzymatic activities and life span of rats. J Gerontol 20:69–71, 1965
[4] Bartke A
Growth hormone and aging: a challenging controversy. Clin Interv Aging 3:659–665, 2008
[5] Bartke A, Brown-Borg H, Kinney B, Mattison J, Wright C, Hauck S, Coschigano K, Kopchick J
Growth hormone and aging. J Am Aging Assoc 23:219–225, 2000
[6] Barzilai N, Gupta G
Revisiting the role of fat mass in the life extension induced by caloric restriction. J Gerontol A Biol Sci Med Sci 54:B89-96; discussion B97-98, 1999
[7] Berg BN, Simms HS
Nutrition and longevity in the rat. II. Longevity and onset of disease with different levels of food intake. J Nutr 71:255–263, 1960
[8] Bertrand HA, Lynd FT, Masoro EJ, Yu BP
Changes in adipose mass and cellularity through the adult life of rats fed ad libitum or a life-prolonging restricted diet. J Gerontol 35:827–835, 1980
[9] Blanc S, Schoeller D, Kemnitz J, Weindruch R, Colman R, Newton W, Wink K, Baum S, Ramsey J
Energy expenditure of rhesus monkeys subjected to 11 years of dietary restriction. J Clin Endocrinol Metab 88:16–23, 2003
[10] Bonkowski MS, Rocha JS, Masternak MM, Al Regaiey, Khalid A, Bartke A
Targeted disruption of growth hormone receptor interferes with the beneficial actions of calorie restriction. Proc Natl Acad Sci U S A 103:7901–7905, 2006
[11] Brown-Borg HM, Borg KE, Meliska CJ, Bartke A
Dwarf mice and the ageing process. Nature 384:33, 1996
[12] Cabo R de, Carmona-Gutierrez D, Bernier M, Hall MN, Madeo F
The search for antiaging interventions: from elixirs to fasting regimens. Cell 157:1515–1526, 2014
[13] Calabrese EJ, Baldwin LA
Hormesis as a biological hypothesis. Environ Health Perspect 106 Suppl 1:357–362, 1998
[14] Cerqueira FM, Kowaltowski AJ
Commonly adopted caloric restriction protocols often involve malnutrition. Ageing Res Rev 9:424–430, 2010
[15] Chen D, Guarente L
SIR2: a potential target for calorie restriction mimetics. Trends Mol Med 13:64–71, 2007
[16] Clancy DJ, Gems D, Hafen E, Leevers SJ, Partridge L
Dietary restriction in long-lived dwarf flies. Science 296:319, 2002
[17] Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, Allison DB, Cruzen C, Simmons HA, Kemnitz JW, Weindruch R
Caloric restriction delays disease onset and mortality in rhesus monkeys. Science 325:201–204, 2009
[18] Colman RJ, Beasley TM, Allison DB, Weindruch R
Attenuation of sarcopenia by dietary restriction in rhesus monkeys. J Gerontol A Biol Sci Med Sci 63:556–559, 2008
[19] Colman RJ, Beasley TM, Kemnitz JW, Johnson SC, Weindruch R, Anderson RM
Caloric restriction reduces age-related and all-cause mortality in rhesus monkeys. Nat Commun 5:3557, 2014
[20] Colman RJ, Ramsey JJ, Roecker EB, Havighurst T, Hudson JC, Kemnitz JW
Body fat distribution with long-term dietary restriction in adult male rhesus macaques. J Gerontol A Biol Sci Med Sci 54:B283-90, 1999
[21] Colman RJ, Roecker EB, Ramsey JJ, Kemnitz JW
The effect of dietary restriction on body composition in adult male and female rhesus macaques. Aging (Milano) 10:83–92, 1998
[22] Coschigano KT, Clemmons D, Bellush LL, Kopchick JJ
Assessment of growth parameters and life span of GHR/BP gene-disrupted mice. Endocrinology 141:2608–2613, 2000
[23] Dice JF
Cellular and molecular mechanisms of aging. Physiol Rev 73:149–159, 1993
[24] Dirks AJ, Leeuwenburgh C
Caloric restriction in humans: potential pitfalls and health concerns. Mech Ageing Dev 127:1–7, 2006
[25] Doblhammer G, Kreft D
Länger leben, länger leiden? Trends in der Lebenserwartung und Gesundheit. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 54:907–914, 2011
[26] Elchuri S, Oberley TD, Qi W, Eisenstein RS, Jackson Roberts L, van Remmen H, Epstein CJ, Huang T
CuZnSOD deficiency leads to persistent and widespread oxidative damage and hepatocarcinogenesis later in life. Oncogene 24:367–380, 2005
[27] Flurkey K, Papaconstantinou J, Miller RA, Harrison DE
Lifespan extension and delayed immune and collagen aging in mutant mice with defects in growth hormone production. Proc Natl Acad Sci U S A 98:6736–6741, 2001
[28] Fontana L, Klein S
Aging, adiposity, and calorie restriction. JAMA 297:986–994, 2007
[29] Fontana L, Klein S, Holloszy JO, Premachandra BN
Effect of long-term calorie restriction with adequate protein and micronutrients on thyroid hormones. J Clin Endocrinol Metab 91:3232–3235, 2006
[30] Fontana L, Meyer TE, Klein S, Holloszy JO
Long-term calorie restriction is highly effective in reducing the risk for atherosclerosis in humans. Proc Natl Acad Sci U S A 101:6659–6663, 2004
[31] Friedman DB, Johnson TE
Three mutants that extend both mean and maximum life span of the nematode, Caenorhabditis elegans, define the age-1 gene. J Gerontol 43:B102-109, 1988
[32] Frye RA
Phylogenetic classification of prokaryotic and eukaryotic Sir2-like proteins. Biochem Biophys Res Commun 273:793–798, 2000
[33] Gems D, Partridge L
Genetics of longevity in model organisms: debates and paradigm shifts. Annu Rev Physiol 75:621–644, 2013
[34] Haigis MC, Guarente LP
Mammalian sirtuins–emerging roles in physiology, aging, and calorie restriction. Genes Dev 20:2913–2921, 2006
[35] Harper JM, Leathers CW, Austad SN
Does caloric restriction extend life in wild mice? Aging Cell 5:441–449, 2006
[36] Harrison DE, Archer JR
Genetic differences in effects of food restriction on aging in mice. J Nutr 117:376–382, 1987
[37] Harrison DE, Archer JR, Astle CM
Effects of food restriction on aging: separation of food intake and adiposity. Proc Natl Acad Sci U S A 81:1835–1838, 1984
[38] Hayflick L
Theories of biological aging. Exp Gerontol 20:145–159, 1985
[39] Hayflick L
Biological aging is no longer an unsolved problem. Ann N Y Acad Sci 1100:1–13, 2007
[40] Heydari AR, Wu B, Takahashi R, Strong R, Richardson A
Expression of heat shock protein 70 is altered by age and diet at the level of transcription. Mol Cell Biol 13:2909–2918, 1993
[41] Heyman MB, Young VR, Fuss P, Tsay R, Joseph L, Roberts SB
Underfeeding and body weight regulation in normal-weight young men. Am J Physiol 263:R250-7, 1992
[42] Holloszy JO, Fontana L
Caloric restriction in humans. Exp Gerontol 42:709–712, 2007
[43] Houthoofd K, Braeckman BP, Johnson TE, Vanfleteren JR
Life extension via dietary restriction is independent of the Ins/IGF-1 signalling pathway in Caenorhabditis elegans. Exp Gerontol 9:947-954, 2003
[44] Hulbert AJ, Clancy DJ, Mair W, Braeckman BP, Gems D, Partridge L
Metabolic rate is not reduced by dietary-restriction or by lowered insulin/IGF-1 signalling and is not correlated with individual lifespan in Drosophila melanogaster. Exp Gerontol 39:1137–1143, 2004
[45] Hursting SD, Switzer BR, French JE, Kari FW
The growth hormone: insulin-like growth factor 1 axis is a mediator of diet restriction-induced inhibition of mononuclear cell leukemia in Fischer rats. Cancer Res 53:2750–2757, 1993
[46] Kaeberlein TL, Smith ED, Tsuchiya M, Welton KL, Thomas JH, Fields S, Kennedy BK, Kaeberlein M
Lifespan extension in Caenorhabditis elegans by complete removal of food. Aging Cell 5:487–494, 2006
[47] Kagawa Y
Impact of Westernization on the nutrition of Japanese: changes in physique, cancer, longevity and centenarians. Prev Med 7:205–217, 1978
[48] Kaletsky R, Murphy CT
The role of insulin/IGF-like signaling in C. elegans longevity and aging. Dis Model Mech 3:415–419, 2010
[49] Keenan KP, Ballam GC, Dixit R, Soper KA, Laroque P, Mattson BA, Adams SP, Coleman JB
The effects of diet, overfeeding and moderate dietary restriction on Sprague-Dawley rat survival, disease and toxicology. J Nutr 127:851S-856S, 1997
[50] Kemnitz JW, Roecker EB, Weindruch R, Elson DF, Baum ST, Bergman RN
Dietary restriction increases insulin sensitivity and lowers blood glucose in rhesus monkeys. Am J Physiol 266:E540-7, 1994
[51] Kemnitz JW, Weindruch R, Roecker EB, Crawford K, Kaufman PL, Ershler WB
Dietary restriction of adult male rhesus monkeys: design, methodology, and preliminary findings from the first year of study. J Gerontol 48:B17-26, 1993
[52] Kenyon C, Chang J, Gensch E, Rudner A, Tabtiang R
A C. elegans mutant that lives twice as long as wild type. Nature 366:461–464, 1993
[53] Kirkwood TB
Evolution of ageing. Nature 270:301–304, 1977
[54] Kirkwood TB, Austad SN
Why do we age? Nature 408:233–238, 2000
[55] Lakowski B, Hekimi S
The genetics of caloric restriction in Caenorhabditis elegans. Proc Natl Acad Sci U S A 95:13091–13096, 1998
[56] Lammert O, Hansen ES
Effects of excessive caloric intake and caloric restriction on body weight and energy expenditure at rest and light exercise. Acta Physiol Scand 114:135–141, 1982
[57] Lane MA, Baer DJ, Rumpler WV, Weindruch R, Ingram DK, Tilmont EM, Cutler RG, Roth GS
Calorie restriction lowers body temperature in rhesus monkeys, consistent with a postulated anti-aging mechanism in rodents. Proc Natl Acad Sci U S A. 93:4159–4164, 1996
[58] Lane MA, Ingram DK, Roth GS
Beyond the rodent model: Calorie restriction in rhesus monkeys. Age (Omaha) 20:45–56, 1997
[59] Liao C, Rikke BA, Johnson TE, Diaz V, Nelson JF
Genetic variation in the murine lifespan response to dietary restriction: from life extension to life shortening. Aging Cell 9:92–95, 2010
[60] Lin SJ, Defossez PA, Guarente L
Requirement of NAD and SIR2 for life-span extension by calorie restriction in Saccharomyces cerevisiae. Science 289:2126–2128, 2000
[61] Mair W, Dillin A
Aging and survival: the genetics of life span extension by dietary restriction. Annu Rev Biochem 77:727–754, 2008
[62] Masoro EJ
Hormesis and the antiaging action of dietary restriction. Exp Gerontol 33:61–66, 1998
[63] Masoro EJ
Overview of caloric restriction and ageing. Mech Ageing Dev 126:913–922, 2005
[64] Masoro EJ
Role of hormesis in life extension by caloric restriction. Dose Response 5:163–173, 2007
[65] Masoro EJ
Caloric restriction-induced life extension of rats and mice: a critique of proposed mechanisms. Biochim Biophys Acta 1790:1040–1048, 2009
[66] Masoro EJ, McCarter RJ, Katz MS, McMahan CA
Dietary restriction alters characteristics of glucose fuel use. J Gerontol 47:B202-8, 1992
[67] Masoro EJ, Yu BP, Bertrand HA
Action of food restriction in delaying the aging process. Proc Natl Acad Sci U S A 79:4239–4241, 1982
[68] Masoro EJ.
Caloric restriction: A key to understanding and modulating aging. Elsevier, Amsterdam, Boston, 1. ed., 2002
[69] Mattison JA, Roth GS, Beasley TM, Tilmont EM, Handy AM, Herbert RL, Longo DL, Allison DB, Young JE, Bryant M, Barnard D, Ward WF, Qi W, Ingram DK, Cabo R de
Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study. Nature 489:318–321, 2012
[70] Mattson MP
Hormesis defined. Ageing Res Rev 7:1–7, 2008
[71] McCarter R, Masoro EJ, Yu BP
Does food restriction retard aging by reducing the metabolic rate? Am J Physiol 248:E488-90, 1985
[72] McCarter RJ, Palmer J
Energy metabolism and aging: a lifelong study of Fischer 344 rats. Am J Physiol 263:E448-52, 1992
[73] McCay CM, Crowell MF, Maynard LA
The effect of retarded growth upon the length of life span and upon the ultimate body size. J Nutr 10:63-79, 1935
[74] Medawar PB
An Unsolved Problem of Biology. HK Lewis, London, 1952
[75] Merry BJ
Molecular mechanisms linking calorie restriction and longevity. Int J Biochem Cell Biol 34:1340–1354, 2002
[76] Merry BJ
Oxidative stress and mitochondrial function with aging–the effects of calorie restriction. Aging Cell 3:7–12, 2004
[77] Metaxakis A, Partridge L
Dietary restriction extends lifespan in wild-derived populations of Drosophila melanogaster. PLoS ONE 8:e74681, 2013
[78] Meydani M, Das S, Band M, Epstein S, Roberts S
The effect of caloric restriction and glycemic load on measures of oxidative stress and antioxidants in humans: results from the CALERIE Trial of Human Caloric Restriction. J Nutr Health Aging 15:456–460, 2011
[79] Meyer TE, Kovács SJ, Ehsani AA, Klein S, Holloszy JO, Fontana L
Long-term caloric restriction ameliorates the decline in diastolic function in humans. J Am Coll Cardiol 47:398–402, 2006
[80] Miller RA, Buehner G, Chang Y, Harper JM, Sigler R, Smith-Wheelock M
Methionine-deficient diet extends mouse lifespan, slows immune and lens aging, alters glucose, T4, IGF-I and insulin levels, and increases hepatocyte MIF levels and stress resistance. Aging Cell 4:119–125, 2005
[81] Muzumdar R, Allison DB, Huffman DM, Ma X, Atzmon G, Einstein FH, Fishman S, Poduval AD, McVei T, Keith SW, Barzilai N
Visceral adipose tissue modulates mammalian longevity. Aging Cell 7:438–440, 2008
[82] Omodei D, Fontana L
Calorie restriction and prevention of age-associated chronic disease. FEBS Lett 585:1537–1542, 2011
[83] Orentreich N, Matias JR, DeFelice A, Zimmerman JA
Low methionine ingestion by rats extends life span. J Nutr 123:269–274, 1993
[84] Partridge L
The new biology of ageing. Philos Trans R Soc Lond B Biol Sci 365:147–154, 2010
[85] Pérez VI, van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A
The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell 8:73–75, 2009
[86] Phillips JP, Campbell SD, Michaud D, Charbonneau M, Hilliker AJ
Null mutation of copper/zinc superoxide dismutase in Drosophila confers hypersensitivity to paraquat and reduced longevity. Proc Natl Acad Sci U S A 86:2761–2765, 1989
[87] Piper MDW, Bartke A
Diet and aging. Cell Metab 2:99-104, 2008
[88] Piper MDW, Mair W, Partridge L
Counting the calories: the role of specific nutrients in extension of life span by food restriction. J. Gerontol. A Biol Sci Med Sci 60:549–555, 2005
[89] Pugh TD, Klopp RG, Weindruch R
Controlling caloric consumption: protocols for rodents and rhesus monkeys. Neurobiol Aging 20:157–165, 1999
[90] Racette SB, Weiss EP, Villareal DT, Arif H, Steger-May K, Schechtman KB, Fontana L, Klein S, Holloszy JO
One year of caloric restriction in humans: feasibility and effects on body composition and abdominal adipose tissue. J Gerontol A Biol Sci Med Sci 61:943–950, 2006
[91] Rattan SIS
Applying hormesis in aging research and therapy. Hum Exp Toxicol 20:281-285, 2001
[92] Rattan, SIS
Aging, anti-aging, and hormesis. Mech Ageing Dev 125:285–289, 2004
[93] Raynes R, Leckey BD, Nguyen K, Westerheide SD
Heat shock and caloric restriction have a synergistic effect on the heat shock response in a sir2.1-dependent manner in Caenorhabditis elegans. J Biol Chem 287:29045–29053, 2012
[94] Rensing L, Rippe V
Altern: Zelluläre und molekulare Grundlagen, körperliche Veränderungen und Erkrankungen, Therapieansätze. Springer, Berlin, Heidelberg, 1. Auflage, 2013
[95] Ross MH
Length of life and caloric intake. Am J Clin Nutr 25:834–838, 1972
[96] Sacher GA
Life table modifications and life prolongation. In: Finch CE, Hayflick L (eds.): Handbook of the Biology of Aging, Van Nostrand Reinhold, New-York, 1. ed., 1977
[97] Schriner SE, Linford NJ, Martin GM, Treuting P, Ogburn CE, Emond M, Coskun PE, Ladiges W, Wolf N, van Remmen H, Wallace DC, Rabinovitch PS
Extension of murine life span by overexpression of catalase targeted to mitochondria. Science 308:1909–1911, 2005
[98] Si H, Liu D
Dietary antiaging phytochemicals and mechanisms associated with prolonged survival. J Nutr Biochem 25:581–591, 2014
[99] Sinclair DA
Toward a unified theory of caloric restriction and longevity regulation. Mech Ageing Dev 126:987–1002, 2005
[100] Sohal RS, Forster MJ
Caloric restriction and the aging process: a critique. Free Radic Biol Med 73:366–382, 2014
[101] Sohal RS, Weindruch R
Oxidative stress, caloric restriction, and aging. Science 273:59–63, 1996
[102] Sonntag WE, Lenham JE, Ingram RL
Effects of aging and dietary restriction on tissue protein synthesis: relationship to plasma insulin-like growth factor-1. J Gerontol 47:B159-163, 1992
[103] Speakman JR, Hambly C
Starving for life: what animal studies can and cannot tell us about the use of caloric restriction to prolong human lifespan. J Nutr 137:1078–1086, 2007
[104] Speakman JR, Mitchell SE
Caloric restriction. Mol Aspects Med 32:159–221, 2011
[105] Stewart TM, Bhapkar M, Das S, Galan K, Martin CK, McAdams L, Pieper C, Redman L, Roberts S, Stein RI, Rochon J, Williamson DA
Comprehensive Assessment of Long-term Effects of Reducing Intake of Energy Phase 2 (CALERIE Phase 2) screening and recruitment: methods and results. Contemp Clin Trials 34:10–20, 2013
[106] Taormina G, Mirisola MG
Calorie restriction in mammals and simple model organisms. Biomed Res Int 2014:308690, 2014
[107] Turturro A, Hass B, Hart RW
Hormesis–implications for risk assessment caloric intake (body weight) as an exemplar. Hum Exp Toxicol 17:454–459, 1998
[108] Turturro A, Witt WW, Lewis S, Hass BS, Lipman RD, Hart RW
Growth Curves and Survival Characteristics of the Animals Used in the Biomarkers of Aging Program. J Gerontol A Biol Sci Med Sci 54:B492, 1999
[109] van Remmen H, Ikeno Y, Hamilton M, Pahlavani M, Wolf N, Thorpe SR, Alderson NL, Baynes JW, Epstein CJ, Huang T, Nelson J, Strong R, Richardson A
Life-long reduction in MnSOD activity results in increased DNA damage and higher incidence of cancer but does not accelerate aging. Physiol Genomics 16:29–37, 2003
[110] Velthuis-te Wierik E J, Westerterp KR, van den Berg H
Impact of a moderately energy-restricted diet on energy metabolism and body composition in non-obese men. Int J Obes Relat Metab Disord 19:318–324, 1995
[111] Villareal DT, Fontana L, Weiss EP, Racette SB, Steger-May K, Schechtman KB, Klein S, Holloszy JO
Bone mineral density response to caloric restriction-induced weight loss or exercise-induced weight loss: a randomized controlled trial. Arch Intern Med 166:2502–2510, 2006
[112] Walford RL, Mock D, Verdery R, MacCallum T
Calorie restriction in biosphere 2: alterations in physiologic, hematologic, hormonal, and biochemical parameters in humans restricted for a 2-year period. J Gerontol A Biol Sci Med Sci 57:B211-224, 2002
[113] Weindruch R, Walford RL
Dietary restriction in mice beginning at 1 year of age: effect on life-span and spontaneous cancer incidence. Science 215:1415–1418, 1982
[114] Weinert BT, Timiras PS
Invited review: Theories of aging. J Appl Physiol 95:1706–1716, 2003
[115] Willcox BJ, Willcox DC, Todoriki H, Fujiyoshi A, Yano K, He Q, Curb JD, Suzuki M
Caloric restriction, the traditional Okinawan diet, and healthy aging: the diet of the world’s longest-lived people and its potential impact on morbidity and life span. Ann N Y Acad Sci 1114:434–455, 2007
[116] Williams GC
Pleiotropy, Natural Selection, and the Evolution of Senescence. Evolution 11:398, 1957
[117] Wilmoth JR
Demography of longevity: past, present, and future trends. Exp Gerontol 35:1111–1129, 2000
[118] Wood JG, Rogina B, Lavu S, Howitz K, Helfand SL, Tatar M, Sinclair D
Sirtuin activators mimic caloric restriction and delay ageing in metazoans. Nature 430:686–689, 2004
[119] Yu BP
Aging and oxidative stress: modulation by dietary restriction. Free Radic Biol Med 21:651–668, 1996
[120] Yu BP, Masoro EJ, McMahan CA
Nutritional influences on aging of Fischer 344 rats: I. Physical, metabolic, and longevity characteristics. J Gerontol 40:657–670, 1985
[121] Zainal TA, Oberley TD, Allison DB, Szweda LI, Weindruch R
Caloric restriction of rhesus monkeys lowers oxidative damage in skeletal muscle. FASEB J 14:1825–1836, 2000
[122] Zimmerman JA, Malloy V, Krajcik R, Orentreich N
Nutritional control of aging. Exp Gerontol 38:47–52, 2003

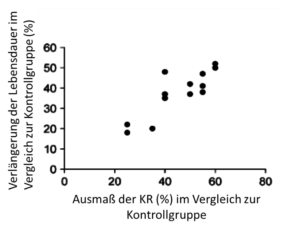
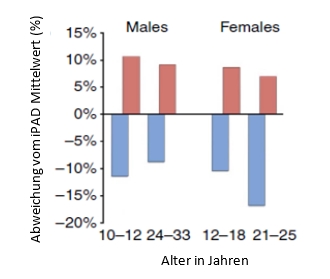
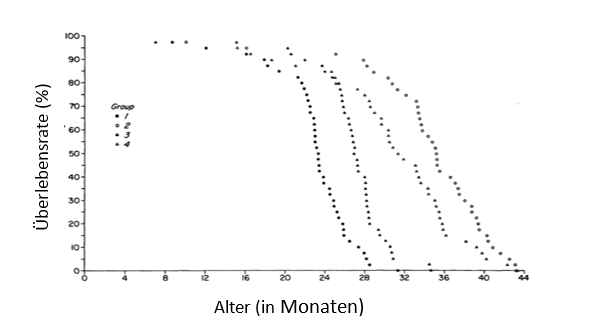
6 comments On Kalorienrestriktion: Ein Überblick zum Stand der Forschung
Ich hatte eigentlich gehofft, daß in einer Antwort die Frage der Kalorienrestriktion etwas geklärt wird, zumal dieses Thema auf edubily häufig angesprochen und positiv bewertet wird.
Hierzu ein Nachtrag: Durch Zufall bin ich auf das Buch
Mythos Übergewicht: Warum dicke Menschen länger leben. Was das Gewicht mit Stress zu tun hat – überraschende Erkenntnisse der Hirnforschung
von Achim Peters, immerhin Professor Dr. med., Hirnforscher, Endokrinologe und Diabetologe (und leitet die interdisziplinäre Forschergruppe „Selfish Brain“ an der Universität Lübeck) gestoßen. Das Buch kommt wie vor wie ein „spin-off“ seines 2011 erschienen „Bestsellers“ „Das egoistische Gehirn“.,
Neben vielen anderen mir befremdlich erscheinenden Meinungen behauptet er dort, daß das, was wir auch mit Intervallfasten verbinden, eine regelmäßig wiederkehrende Kalorienrestriktion, und Gewichthalten (auf einem niedrigeren Niveau als „dick“) durch bewußten Verzicht auf hyperkalorisch Nahrungaufnahme, also Nahrungszufuhrkontrolle, schädlich sei: Dies sei , wie er es nennt, „gezügeltes Essen“ („restrained eating“) und führe zu dauerhaftem Streß, erhöhte Cortisolausschüttungen und verkürzte Lebenserwartungen. Z.B. S.56:
„Tatsächlich belegen neue klinische Studien, dass gezügelte Esser im Vergleich zu Kontrollpersonen erhöhte Cortisolwerte im Blut haben, in den unterschiedlichsten kognitiven Tests schlechter abschneiden, häufiger an Depression leiden, eine verminderte Knochenmasse und häufigere Menstruationsunregelmäßigkeiten aufweisen und letztlich sogar Hinweise für vorzeitiges Altern zeigen (Verkürzung der Chromosomen-Länge).“
Das ist nun mal genau das Gegenteil der u.a. auch hier positiv konnotierten „dauerhaften“ Kalorienrestriktion (wie immer auch man dies zu verstehen hat).
Es würde mich wirklich eure Meinung dazu interessieren.
Wie in der Einleitung bereits angedeutet bringt die Arbeit für den schon etwas Eingelesenen keine wirklichen Neuigkeiten, ist aber auch für den schon Informierten eine sehr gut brauchbare Übersicht und Zusammenfassung. Schade nur, daß es noch keine wirklich belastbaren Erkenntnisse hinsichtlich der Modalitäten und Auswirkungen auf/für Menschen gibt.
Beim Thema Kalorienrestriktion frage ich mich aber immer, was der Vergleich ist, d.h. im Vergleich mit was „begrenzt“ wird: Dem, was durchschnittlich gegessen wird? Meinem persönlichen, aktuellen Gesamtbedarf? Meinem persönlichen, aktuellen Grundbedarf?
Denn begrenze ich ich dauernd, dauerhaft meine Kalorienzufuhr im Vergeich zu meinem Gesamtbedarf, dann ernähre ich mich hypokalorisch und werde zumindest abnehmen (und jedenfalls bei zu großer Differenz gibt es auch noch die bekannten, unerwünschten Veränderungen, Reduzierungen meines Stoffwechsels, weniger Leptin, weniger T3). Das geht dann solange, bis sich durch Reduzierung des Gewichts und Veränderung des Stoffwechsels der Gesamtbedarf mit der Kalorienzufuhr in der Waage halten. Und dann ist Schluß mit „dieser“ Kalorienrestriktion.
Ich gebe zu, bei dem an anderer Stelle dargestellten ADF mit 50% / 150% o.ä. stellt sich dieses Problem nicht, wohl auch nicht bei 0% / 200% (was – 0% – ich auf Dauer aber nicht könnte, selbst 50% an mehrere Tagen in der Woche zu essen könnte ich auf Dauer nicht, IF 16/8 ist dagegen kein Problem) – aber Studie hin, Studie her, irgendwie kann ich nicht recht glauben, daß drei Tage fressen und drei Tage den Gürtel enger schnallen wirklich funktionieren kann, sowohl als Konzept wie auch als „wirkenden“ Kalorienrestriktion.
Ich hatte „Kalorienrestriktion“ bislang so verstanden, daß ständig, dauerhaft die Kalorienzufuhr begrenzt wird. Und zwar faktisch im Vergleich mit der sich überernährenden Mehrheit der Bevölkerung. Also bspw. ohne Sportler zu sein (Sport macht nicht jedem Spaß, auch wenn es „euch“ vielleicht nicht verständlich ist) einen mittleren Normal-BMI halten, indem man sich beim Essen zurückhält. Man ißt so weniger als man essen könnte, aber auch nicht weniger, als man für das Halten des Gewichts benötigt. “ Also Kalorienrestriktion“ in dem von mir so verstandenen Sinn, nicht unter seinem Gesamtbedarf zu bleiben (was ja dauerhaft nicht funktionieren kann) sondern weniger als man essen könnte, als „die Mehrheit ist“, freiwillig auf „unnötige“, „übermäßige“ Nahrungszufuhr verzichten, schlank bleiben, sich nicht überernähren, wobei es dafür aber wohl kaum objektive Maßstäbe gibt (oder doch?).
Interessanter Artikel, vielen Dank.
Da ich mich auch mit dem Thema vorher schon eine Weile beschäftigt hatte, wundert mich ein bißchen, daß Professor Valter Longo im Text nicht aufgetaucht ist. Der wäre ja als Spezialist für dieses Thema eigentlich eine der Top-Referenzen. Seine von ihm als „fasting mimicking diet“ (FMD) bezeichnete Ernährung hat er sowohl an Mäusen als auch an Menschen getestet, wobei natürlich bei Menschen aufgrund der kurzen Studienzeit keine Aussagen gemacht werden können, ob dadurch eine Verlängerung der Lebensdauer erreicht werden kann (immerhin kam es zu deutlich verbesserten Blutwerten).
Wen es interessiert: auf YouTube ist einiges von Valter Longo zu finden (Ted Talk, Interviews usw.)
Gruß
Ashton
Hallo, die in den Abschnitten 3.3.1 und 3.3.3 beschriebenen Verringerungen des T3-Spiegels und die im Abschnitt 4.3 erwähnten unverändert hohen Stoffwechselraten nach einem kurzen negativen Peak gehen für mich igendwie nicht zusammen. Oder wurden die niedrigen Triiodthyronin-Spiegel nur am Beginn der KR gemessen?
Gruß Lutz
Hallo, ich probiere dir mal deine Frage zu beantworten. Also der Effekt, dass der T3 Spiegel bei einer verringerten Nahrungsaufnahme absinkt stimmt so und hängt beim Mensch (wahrscheinlich) auch eng mit einer Abnahme des Leptins zusammen. Ein verringerter T3-Spiegel führt auch zu einem verringerten Grundumsatz und auch zu einem geringeren Energieverbrauch.
Jedoch beschreibt die Hypothese (in 4.3), dass eine verringerte Stoffwechselrate durch KR für einige (oder sogar alle) Effekte der KR verantwortlich sind. Den Schluss – geringere T3 Werte = geringere Stoffwechselrate – kann man nicht so einfach ziehen . Man muss bedenken, dass Tier/Mensch unter KR womöglich eine erhöhte Bereitschaft zur Nahrungssuche zeigen (mehr Bewegung=erhöhte Stoffwechselrate). Zusätzlich sind ja auch viele andere Prozesse (auch auf der Zellebene) durch eine KR beeinflusst, bspw. mehr und effizientere Mitochondrien. Oder andere günstige Einflüsse auf verschiedene Stoffwechselwege.
Bei einer KR um 25% wird man Körpergewicht verlieren (je nach Lebensstil mehr oder weniger fettfreie Körpermasse), aber irgendwann ist die Körperzusammensetzung auch daran angepasst und wird sich nicht mehr so erheblich verändern.
Also ein verringerten T3 Spiegel kann zu einem geringeren Energieverbrauch führen, aber entscheidet am Ende nicht über die gesamte Stoffwechselrate.
Hoffe du kannst mit der Antwort etwas anfangen. Sonst kannst du gerne die Frage nochmal konkretisieren.
Danke, erhöhter Bewegungsdrang (Nahrungssuche) und gesteigerte Anzahl der Mito’s und deren Effizienz ist einleuchtend.