2010 und 2011 waren große Jahre, wenn es um die Effekte von BCAA hinsichtlich Langlebigkeit geht. Es konnte nämlich gezeigt werden, dass BCAA-Supplementation dazu führt, dass der Muskel über mehr Mitochondrien verfügt – auch im Herzen! – und die Tiere insgesamt länger leben [12] [13]. Doch warum und wie funktioniert das?
Die Wirkweise von BCAA
Ich möchte gar nicht lange erzählen, sondern erläutere nun die Punkte, die erklären könnten, warum BCAA das, dein Leben verlängern können:
1) mTOR/eNOS-Signalling
BCAA, insbesondere Leucin, kann – wie lange bekannt – mTOR „anschalten“, was normalerweise einhergeht mit einer niedrigeren AMPK-Aktivität. Soweit kennen wir, selbst die Hobbysportler, die Theorie.
Es konnte gezeigt werden, dass mTOR offensichtlich auch mit NO (Stickstoffmonoxid) wechselwirkt. Hemmt man eNOS, das für die NO-Synthese zuständige Enzym, dann bleiben die Effekte von BCAA (auf Muskel und Organismus) aus. Hier gibt es zwei Erklärungsansätze: Zum einen scheint NO dafür benötigt zu werden, dass BCAA überhaupt mTOR aktivieren [13]. Auf der anderen Seite scheint mTOR dafür verantwortlich zu sein, dass mehr NO entsteht. NO an sich ist dafür bekannt, Mitochondrien zu vermehren und für mehr ATP-Produktion zu sorgen (siehe Anmerkung).
Es ist bekannt, dass NO (Stickstoffmonoxid) direkt AMPK bzw. mTOR aktiviert und das Gewebe-spezifisch [14] [15]. Darüber hinaus konnte gezeigt werden, dass NO auch direkt dafür verantwortlich ist, dass mehr Mitochondrien entstehen via PGC-1alpha. Hemmt man die NO-Synthese, dann entsteht eine mitochondriale Dysfunktion. Und es kommt noch schlimmer: Hemmt man die NO-Synthese, dann bleibt der AMPK-induzierende Effekt auf die Mitochondrien-Neubildung aus [16]!
Heißt: BCAA könnten deshalb so wirken, weil sie mit dem NO-Signalweg interagieren. Übrigens ist das auch ein Wink mit dem Zaunpfahl: Ich wurde von einigen zwar belächelt, als ich sagte, dass NO ein Stoffwechselmasterregulator ist, aber na ja, ich habe das aus gutem Grund gesagt. Wer noch nicht Bescheid weiß: Es gibt bei uns einen topaktuellen NO-Guide – nicht über NO philosophieren, wenn man die Hintergründe nicht kent.
2) Substrate für Citrat-Zyklus
Der Citrat-Zyklus ist wohl der entscheidende Teil, wenn es um deine persönliche Energie-Produktion geht. Dort nämlich fließt das Abbau-Produkt des Kohlenhydrat- bzw. Fettstoffwechsels ein, Acetyl-CoA. Dieses Acetyl-CoA wird mit Hilfe vieler Reaktionsschritte dann weiter „modifiziert“ – dabei werden Elektronen auf „Elektronen-Transporter“ übertragen, die die Elektronen zur Atmungskette bringen, wo letztendlich deine Energie, ATP, entsteht.
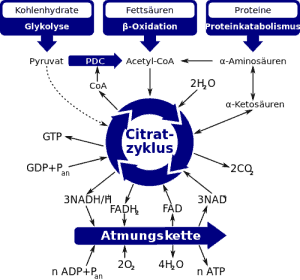
Entscheidend für uns ist folgender Gedanke: Der Citrat-Zyklus ist dadurch gekennzeichnet, dass Acetyl-CoA über mehrere Schritte so modifiziert wird, dass Elektronen abgegeben werden. Dadurch wird Acetyl-CoA selbst in andere Substanzen „umgewandelt“ – was aber passiert, wenn wir die einzelnen Substanzen herausnehmen oder einfügen? Und die Antwort ist banal:
Intermediär-Substanzen, wie beispielsweise Citrat, Isocitrat, alpha-Ketoglutarat, Succinat, Fumarat, Malat, Oxaloacetat, werden konstant herausgenommen, um in anderen chemischen Reaktionen als Substrat zu dienen. Und der Körper baut die eben genannten Substanzen auch konstant in diesen Zyklus ein. Es ist also ein Geben und Nehmen.
In der Tat wurde im British Journal of Sports Medicine [1] beispielsweise gezeigt, dass die Gabe von Citrullin-Malat dafür sorgt, dass der Muskel 30 % mehr ATP produziert. Wenngleich man diese Ergebnisse natürlich auch auf Arginin bzw. Citrullin zurückführen kann, merken die Autoren an, dass der Effekt durchaus auch aufgrund von Malat entstehen kann. Denn Malat – als Substanz des Citrat-Zyklus – könnte Reaktionsgeschwindigkeiten beeinflussen und somit dafür sorgen, dass mehr Energie frei wird.
Das war der erste Hinweis darauf, dass eine exogene Gabe von Citrat-Zyklus-Intermediären (z. B. Malat) eine Wirkung hervorrufen kann.
Noch interessanter wurde es, als ich entdeckte, dass …
- Oxaloacetat [2]
- alpha-Ketoglutarat [3]
- Malat [4]
- und Fumarat [4]
… alle das Leben verlängern können.
Gezeigt, natürlich, bisher nur an C. elegans, unserem Fadenwurm, aber Zelle ist Zelle. Daran sollten wir definitiv denken.
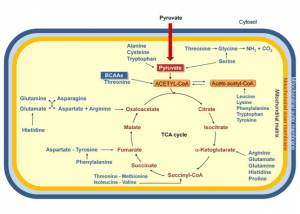
Und jetzt kommt der springende Punkt: BCAA werden abgebaut durch ein spezielles Enzyme namens Aminotransferase. Dabei entsteht u. a. alpha-Ketoglutarat – eine Intermediär-Substanz des Citrat-Zyklus (siehe oben).
Außerdem entsteht bei weiterem Abbau … Succinyl-CoA, das ebenfalls ein Bestandteil des Citrat-Zyklus ist (siehe oben, Grafik rechts).
Es wäre denkbar, dass BCAA-Supplementation dafür sorgt, dass sowohl alpha-Ketoglutarat, als auch Succinyl-CoA gebildet und als Substrat im Citrat-Zyklus verwendet werden. Und … dadurch entsteht Langlebigkeit. Achtung: Nur eine Hypothese!
3) BCAA induzieren direkt eine Mitochondrien-Neubildung durch BCAA-Katabolismus
Den BCAA-Katabolismus hatten wir eben ja schon.
Kalorienrestriktion, das nachweislich dein Leben verlängert, sorgt dafür, dass mehr Mitochondrien entstehen. Das scheint offensichtlich auch deshalb zu passieren, weil Kalorienrestriktion dafür sorgt, dass vermehrt BCAA abgebaut werden.
Kenner unter euch wissen vielleicht, dass der erste Schritt des Aminosäure-Abbaus in den Mitochondrien abläuft. Tatsächlich ist es so, dass Kalorienrestriktion Sirt5 aktiv macht [5], das dafür zuständig ist, dass Aminosäuren – in den Mitochondrien – ordentlich abgebaut werden – sowohl während einer Kalorienrestriktion, als auch während einer „high protein diet“.
Interessant auch, dass Kalorienrestriktion ein weiteres Sirtuin reguliert, nämlich Sirt3, das mit dem (ihr wisst Bescheid) bekannten PGC-1alpha interagiert und essentiell ist für die mitochondriale Funktion, für den mitochondrialen Fettstoffwechsel (= ß-Oxidation) und … ganz wichtig … für den Aminosäure-Abbau [6]. Dieses Sirt3 ist so wichtig bezogen auf deine Gesundheit, dass eine Arbeit unter anderem titelt: „Forever young: Sirt3 – ein Schutzschild gegen Mitochondrien-Abbau, Altern und Neurodegeneration“ [7].
Auch hier kann man also vermuten, dass der BCAA-Abbau die Effekte einer Kalorienrestriktion „mimt“ (= nachahmt) via Sirt3 und Sirt5.
Kalorienrestriktion geht einher mit gesteigertem Protein-Abbau. Eine „high protein diet“ kann diese Effekte „mimen“ (= nachahmen), da ebenfalls vermehrt Aminosäuren abgebaut werden (müssen). Daber werden Sirt3 und Sirt5 reguliert, die beide im direkten Zusammenhang stehen mit Mitochondrienfunktion und Alterung.
4) BCAA regulieren direkt den klassischen „Signalweg der Langlebigkeit“ (AMPK/Sirt1/PGC-1alpha)
Wir alle wissen, dass Leucin den „anabolen Signalweg“ aktiviert, also den PI3k/Akt/mTOR-Signalweg. Daher schlucken so viele Menschen BCAA und Leucin usw.
Vielen aber ist nicht bekannt, dass Leucin offensichtlich auch seine Finger im Spiel hat, wenn es um den „Signalweg der Langlebigkeit“ geht.
Scheinbar sorgt Leucin dafür, dass wir eine erhöhte Expression bzw. Aktivität von
- AMPK [8] [9] [10] [11]
- Sirt1 [8] [9] [10] [11]
- PGC-1alpha [8] [9] [10]
Interessant ist, dass Leucin offensichtlich ein Sirt1-Agonist ist und somit Sirt1 „aktivieren“ kann [11].
Das Problem wird klar: Was entscheidet darüber, in welche Richtung eine Leucin-Gabe geht? Interessant hierbei ist, dass Leucin womöglich dann Sirt1 etc. aktiv macht, wenn die Zelle unter Glukose-Stress leidet (z. B. bei Insulin-Resistenz etc.) – man könnte hier also vermuten, dass Leucin die zellulären Stoffwechselwege je nach Energie-Zustand moduliert („zu viel Energie“ = Sirt1/AMPK etc. vs. „zu wenig Energie“ = mTOR etc.) . Aber das sind nur Hypothesen.
BCAA könnten deshalb dafür sorgen, dass wir länger leben, da Leucin die klassischen Signalwege der Langlebigkeit aktiviert (AMPK/Sirt1/PGC-1alpha).
Zur Forendiskussion
Referenzen
[1] Bendahan, D. (2002). Citrulline/malate promotes aerobic energy production in human exercising muscle. British Journal of Sports Medicine, 36(4), pp.282-289.
[2] Williams, D., Cash, A., Hamadani, L. and Diemer, T. (2009). Oxaloacetate supplementation increases lifespan in Caenorhabditis elegans through an AMPK/FOXO-dependent pathway. Aging Cell, 8(6), pp.765-768.
[3] Chin, R., Fu, X., Pai, M., Vergnes, L., Hwang, H., Deng, G., Diep, S., Lomenick, B., Meli, V., Monsalve, G., Hu, E., Whelan, S., Wang, J., Jung, G., Solis, G., Fazlollahi, F., Kaweeteerawat, C., Quach, A., Nili, M., Krall, A., Godwin, H., Chang, H., Faull, K., Guo, F., Jiang, M., Trauger, S., Saghatelian, A., Braas, D., Christofk, H., Clarke, C., Teitell, M., Petrascheck, M., Reue, K., Jung, M., Frand, A. and Huang, J. (2014). The metabolite α-ketoglutarate extends lifespan by inhibiting ATP synthase and TOR. Nature.
[4] Edwards, C., Copes, N., Brito, A., Canfield, J. and Bradshaw, P. (2013). Malate and Fumarate Extend Lifespan in Caenorhabditis elegans. PLoS ONE, 8(3), p.e58345.
[5] Nakagawa, T., Lomb, D., Haigis, M. and Guarente, L. (2009). SIRT5 Deacetylates Carbamoyl Phosphate Synthetase 1 and Regulates the Urea Cycle. Cell, 137(3), pp.560-570.
[6] Hallows, W., Yu, W., Smith, B., Devires, M., Ellinger, J., Someya, S., Shortreed, M., Prolla, T., Markley, J., Smith, L., Zhao, S., Guan, K. and Denu, J. (2011). Sirt3 Promotes the Urea Cycle and Fatty Acid Oxidation during Dietary Restriction. Molecular Cell, 41(2), pp.139-149.
[7] Kincaid, B. and Bossy-Wetzel, E. (2013). Forever young: SIRT3 a shield against mitochondrial meltdown, aging, and neurodegeneration. Frontiers in Aging Neuroscience, 5.
[8] Sun, X. and Zemel, M. (2009). Leucine modulation of mitochondrial mass and oxygen consumption in skeletal muscle cells and adipocytes. Nutr Metab (Lond), 6(1), p.26.
[9] Li, H., Xu, M., Lee, J., He, C. and Xie, Z. (2012). Leucine supplementation increases SIRT1 expression and prevents mitochondrial dysfunction and metabolic disorders in high-fat diet-induced obese mice. AJP: Endocrinology and Metabolism, 303(10), pp.E1234-E1244.
[10] Liang, C., Curry, B., Brown, P. and Zemel, M. (2014). Leucine Modulates Mitochondrial Biogenesis and SIRT1-AMPK Signaling in C2C12 Myotubes. Journal of Nutrition and Metabolism, 2014, pp.1-11.
[11] Bruckbauer, A. and Zemel, M. (2014). Synergistic Effects of Polyphenols and Methylxanthines with Leucine on AMPK/Sirtuin-Mediated Metabolism in Muscle Cells and Adipocytes. PLoS ONE, 9(2), p.e89166.
[12] D’Antona, G., Ragni, M., Cardile, A., Tedesco, L., Dossena, M., Bruttini, F., Caliaro, F., Corsetti, G., Bottinelli, R., Carruba, M., Valerio, A. and Nisoli, E. (2010). Branched-Chain Amino Acid Supplementation Promotes Survival and Supports Cardiac and Skeletal Muscle Mitochondrial Biogenesis in Middle-Aged Mice.Cell Metabolism, 12(4), pp.362-372.
[13] Valerio, Alessandra, Giuseppe D’Antona, and Enzo Nisoli. „Branched-chain amino acids, mitochondrial biogenesis, and healthspan: an evolutionary perspective.“ Aging (Albany NY) 3.5 (2011): 464.
[14] Tan, B. (2012). Regulatory roles for L-arginine in reducing white adipose tissue. Front Biosci, 17(7), p.2237.
[15] McKnight, J., Satterfield, M., Jobgen, W., Smith, S., Spencer, T., Meininger, C., McNeal, C. and Wu, G. (2010). Beneficial effects of l-arginine on reducing obesity: potential mechanisms and important implications for human health. Amino Acids, 39(2), pp.349-357.
[16] Lira, V., Brown, D., Lira, A., Kavazis, A., Soltow, Q., Zeanah, E. and Criswell, D. (2010). Nitric oxide and AMPK cooperatively regulate PGC-1α in skeletal muscle cells. The Journal of Physiology, 588(18), pp.3551-3566.
